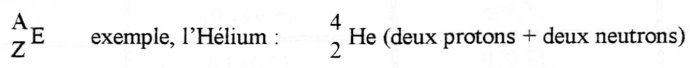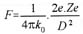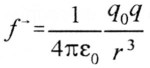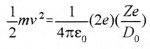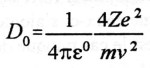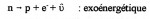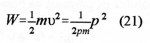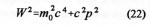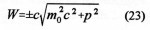Article paru dans le Bulletin du G.E.S.T., N° 132, juillet 2005
Dossier « Nucléaire » XIV
Robert SIX
I. LA RECHERCHE EN GRANDE BRETAGNE EN 1940
En Grande-Bretagne, plusieurs équipes universitaires travaillent sur la fission nucléaire, indépendamment les unes des autres. Ce sont, le très célèbre laboratoire Cavendish de l’université de Cambridge, où James Chadwick découvrit la nature du neutron en 1932; les laboratoires des universités de Birmingham et d’Oxford, l‘Imperial College de Londres. Le pays est l’un des principaux foyers mondiaux de recherche fondamentale en physique nucléaire. Il suffit de se rappeler :
-
Ernest Rutherford (1871-1937) qui découvrit la radioactivité du thorium en 1899 et mis en évidence, les rayons α et β émit par le rayonnement des radioéléments; sa loi des transformations radioactives énoncée avec Soddy, et bien d’autres contributions à l’avancement dans la connaissance de la physique nucléaire;
-
James Chadwick (1891-1974) qui étudia la charge des noyaux et la désintégration artificielle, mit en évidence l’effet photo-électrique, et son neutron, bien entendu;
-
Ainsi que les autres savants dont Joseph John Thompson (1856-1940); John Douglas Cockroft (1897-1967), etc.
Dès le printemps 1939, après la parution dans Nature des travaux de Joliot-Curie, George P. Thompson, professeur de physique à l‘Imperial College de Londres, prend contact avec Sir Henry TIZARD, président, depuis 1934, du comité scientifique du Ministère de l’Air pour la défense aérienne. Ce dernier conseille à Thompson de se rendre au Ministère de l’Air et d’exposer aux responsables les conséquences militaires et techniques que peuvent entraîner les découvertes des Français. De plus, des nouvelles alarmistes en provenance d’Allemagne laissent entendre que les atomistes allemands se sont lancés dans la course à la bombe. Le Gouvernement britannique confie la tâche à Tizard d’obtenir des différents groupes de scientifiques qu’ils unissent leurs efforts et coordonnent leurs recherches. Sa mission première est d’étudier les possibilités de construction d’une arme nucléaire. Soulignons que le personnage joua un rôle déterminant dans l’implantation du réseau des stations de radars qui protégea la Grande-Bretagne lors de la Bataille d’Angleterre.
Très vite, Tizard se rend compte des faiblesses matérielles et financières de son pays dans ce domaine. Scepticisme que partage Lord Cherwell, le conseiller scientifique de Winston Churchill. Les savants anglais surestiment la quantité d’uranium 235 nécessaire pour atteindre la masse critique. Il leur faut plusieurs centaines de kilo voire plusieurs tonnes de matériel fissile. La séparation isotopique de 235U des autres isotopes paraît insurmontable. De plus, ils ignorent les effets produits par une réaction en chaîne: simple déflagration ou explosion gigantesque ?
Cherwell suggère à Churchill de prévenir le secrétaire d’état à l’Aviation, Sir Kingley Wood, que malgré l’intérêt scientifique de la fission nucléaire, il est « peu probable que cette découverte conduise avant plusieurs années à des résultats susceptibles d’une application ».
Dès l’avènement d’Hitler au pouvoir, plusieurs scientifiques allemands quittent leur pays et se réfugient au Royaume-Uni où ils intégreront les équipes des différentes universités. C’est ainsi que l’on trouve Rudolf PEIERLS, qui parvient en juin 1939 à une évaluation plus fine de la masse critique, et Otto Frisch, qui en février – mars 1940, avec l’aide de son compatriote réussit à calculer la masse critique de l’235U et émet l’hypothèse qu’un neutron frappant un noyau d’uranium 235 provoque la fission de celui-ci et qu’une réaction en chaîne peut s’enclencher. D’autres savants les rejoindront, comme Franz Simon et Klaus Fuchs.
En mars 1940, Otto Frisch rédige deux rapports qui remettent le problème de la faisabilité d’une bombe atomique en question: « De la construction d’une superbombe basée sur une réaction nucléaire de l’uranium» et «Mémoire sur les propriétés d’une superbombe radioactive ». Ces rapports, qui atterrissent sur le bureau de Tizard, proposent une étude technique de la bombe et abordent également les questions stratégique et éthique. Ces deux rapports sont d’une importance capitale, car les calculs de FRISCH et Peierls démontrent que la déflagration serait égale à celle de 1.000 tonnes de TNT: « Cette énergie, annoncent-ils, est libérée sous un faible volume: il se produira, à l’intérieur, pendant un temps extrêmement bref, un dégagement de chaleur comparable à celui du centre du soleil. L’effet d’une telle explosion pourrait détruire toute vie sur une très grande zone. L’importance de cette zone est difficile à apprécier, mais elle couvrirait probablement le centre d’une grande ville. » De plus, leurs calculs montrent que la masse critique de matières fissiles se limite à quelques kilogrammes et non plus à des tonnes.
Tizard réunit un groupe de réflexion pour « examiner l’ensemble du problème, coordonner le travail de recherche et préciser dans les meilleurs délais s’il est possible de produire des bombes nucléaires pendant la guerre ». Ce comité, qui prend le nom de M.A.U.D. (Military Application of Uranium Detonation), doit également juger « si les effets militaires de ces bombes donneraient des résultats suffisants pour justifier une dispersion de l’effort de guerre ».
Un autre fait va alimenter le processus enclenché par le Gouvernement britannique: c’est l’arrivée en Grande-Bretagne des deux scientifiques français, Hans Halban et Lev Kowarski, avec leur stock d’eau lourde.
II. LE RAPPORT HALBAN-KOW ARSKI DE LONDRES
Dès qu’ils touchèrent le sol britannique, les deux collaborateurs de Frédéric Joliot-Curie exilés sont invités à ne pas s’engager dans les Forces Libres du général de Gaulle. Ils sont affectés au laboratoire de l’université de Cambridge, où ils peuvent reprendre leurs expériences interrompues par l’invasion allemande et leur fuite en Angleterre, en rejoignant le projet « Directorate of Tube Alloys» (TA) qui, sous le couvert de fabrication de tube d’alliage, consistait à mettre au point les techniques permettant la fabrication d’une bombe nucléaire. C’est ainsi, qu’ils livrèrent secrets et brevets français aux Anglais.
A la juin – début juillet 1940, les deux physiciens français rédigèrent un rapport dans lequel ils dévoilaient les derniers résultats obtenus par l’équipe française et les conclusions qui en découlaient.
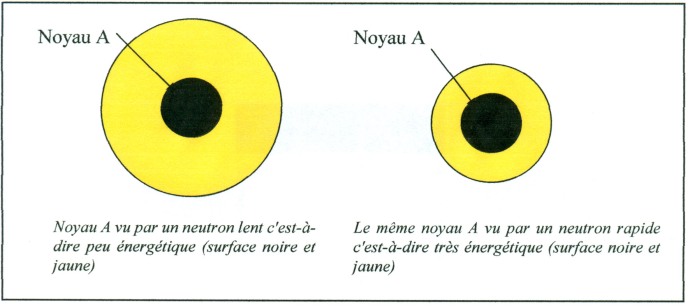
« Discussion de la composition et de la constitution de systèmes contenant de l’uranium en vue de produire une réaction en chaîne nucléaire divergente» spécifie que «pour réaliser une réaction en chaîne divergente, quatre méthodes devraient réussir: l’utilisation d’un mélange homogène uranium – eau lourde, ou bien un dispositif hétérogène (sous forme d’une sphère ou d’un empilement) avec de l’uranium et de l’eau ordinaire, ou de l’uranium et de l’eau lourde ou encore de l’uranium et du carbone. Une combinaison comportant de l’uranium légèrement enrichi en isotope 235 serait très favorable et pourrait marcher avec de l’eau ordinaire. Deux voies sont préconisées pour la production d’énergie: la méthode des neutrons lents avec un petit enrichissement en uranium 235 ; ou l’espoir que la capture de neutrons par l’uranium 238 conduise en fin de compte à un nouveau noyau fissile ». Ce sera le plutonium découvert au début 1941 à Berkeley (USA).
III. LA RECHERCHE S’INTENSIFIE EN GRANDE-BRETAGNE
En cette fin de 1941, le groupe anglais est en tête dans l’étude de la possibilité d’une réaction en chaîne, grâce aux méthodes françaises et au stock d’eau lourde amené par les deux Français. Mais, de nombreux détails d’ordre pratique doivent encore être résolus.
La mise sur pied du Comité M.A.UD. entraîne la mobilisation de groupes industriels pour résoudre certains des problèmes techniques, comme, notamment, ICI (Imperial Chemical Industries).
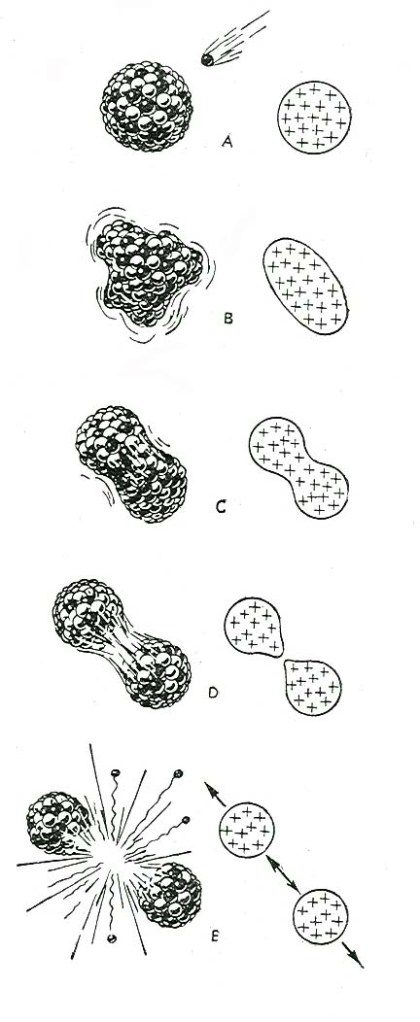
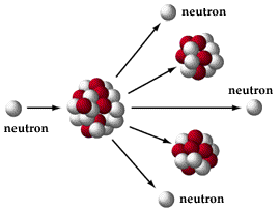
Le principe de la bombe est arrêté: il suffit de précipiter deux blocs d’235U l’un sur l’autre pour obtenir la masse critique et enclencher la réaction en chaîne qui s’emballant provoquera l’explosion. Malheureusement, la fabrication de l’235U se révèle être un challenge. En effet, l’235U n’existe que dans la proportion de 0,7% dans l’uranium naturel. Ayant les mêmes propriétés, il est très difficile, si pas improbable, de séparer les deux isotopes. Aucune technique n’est à ce moment connue, ni même envisagée.
En dépit de sa valeur exceptionnelle, la physique nucléaire britannique n’a pas les moyens financiers et techniques pour entreprendre, durant la guerre, la mise au point de bombes nucléaires. C’est pourquoi, le 17 juin 1942, le chef du Gouvernement de Sa Majesté, Winston Churchill, rejoint Hyde Park dans l’Etat de New York, à bord d’un hydravion à coque, pour y rencontrer le président américain Roosevelt. Les deux hommes décident de concentrer la recherche aux Etats-Unis, et mettent au point un programme pour les dix-huit mois à venir. Au départ, Washington présentait quelques réticences à embrasser la cause de la bombe nucléaire. Mais, l’augmentation de la production de l’eau lourde ordonnée par les Allemands qui ont envahi la Norvège et réquisitionné l’usine de Norsk Hydro et l’embargo sur l’exportation du minerai d’uranium tchécoslovaque, laissent à penser que l’ennemi était proche de mettre au point un armement nucléaire. Churchill qui se serait « fort bien contenté des explosifs existants », se voyait donc obligé de se lancer dans cette course, avec l’accord de ROOSEVELT. « Nous avions l’un et l’autre le sentiment qu’il était fort dangereux de rester inactif dans ce domaine, écrit-il. Nous savions quels efforts les Allemands faisaient pour constituer des réserves d’eau lourde, terme sinistre, étrange et presque surnaturel qui commençait à se glisser dans nos documents secrets. Et si l’ennemi réalisait avant nous cette bombe atomique? Pour sceptiques que nous fussions devant les assertions de certains savants, nous ne pouvions pas courir le risque mortel de nous trouver devancés dans ce domaine terrifiant ».
De retour en Angleterre, le premier ministre décide de lancer un plan d’attaque pour détruire le stock d’eau lourde de l’usine norvégienne.
IV. LA BATAILLE DE L’EAU LOURDE
Je renvoie le lecteur à l’article précédent dans lequel j’annonce le récit de Jean Marin, scénariste du film « La Bataille de l’eau lourde ». Un deuxième film a été tourné plus tard, en 1965 sous le titre de « The heroes of Telemark » avec en vedettes principales Kirk Douglas et Richard Harris. Réalisé par Anthony Mann, sur un scénario de Ben Barzman et Ivan Moffat, d’après le roman de John Drummond et Knut Haukelid, il respecte peu la vérité historique. L’aventure se termine par le sauvetage in extremis (suspens oblige) d’un groupe d’enfants et de leur accompagnatrice, embarqués sur le ferry transportant les bidons d’eau lourde, par le héros (K. Douglas). En réalité, l’explosion du navire a entraîné la mort de 26 personnes sur les 53 passagers et l’équipage.
Laissons à nouveau la plume à Jean Marin qui nous conte l’extraordinaire aventure d’hommes de courage sacrifiés pour des craintes qui, en définitive, s’avéreront non justifiées.
V
PARACHUTAGES EN NORVEGE
Dans l’abri de Churchill.
Dans l’abri qu’on a construit pour lui sous la pelouse du n° 10 de Downing Street, Winston Churchill est assis à sa table de travail. Le cigare en bataille, le nez chaussé de grosses lunettes d’écaille, il donne toute son attention à la lecture des derniers rapports de son ministre de la guerre économique. Il y apprend que le Reich, qui a déjà donné l’ordre à l’usine de Rjukan de porter sa production annuelle d’eau lourde à 1.500 kilos, exige maintenant qu’en 1942, cette production soit portée à 5.000 kilos par an.
Churchill croit aux armes secrètes et il sait qu’Hitler y croit encore davantage. Le danger est là. L’Allemagne est engagée à fond dans la course à l’eau lourde. Elle devine à peu près où en sont parvenus les progrès des Alliés dans le domaine de l’énergie .atomique; elle veut arriver bonne première.
L’une des feuilles dactylographiées éparpillées sur le bureau fait apparaître un nom que Churchill connaît bien : Tronjstadt, le Professeur Leif Tronjstadt, chargé de l’enseignement de la chimie industrielle à l’Université de Trondjheim.
Ce savant norvégien, grand spécialiste de la fabrication de l’eau lourde, pour qui l’usine de Rjukan n’a pas de secret, vient d’arriver en Angleterre. Il a des contacts sûrs et réguliers avec les patriotes ardents que compte le personnel de Rjukan. C’est lui qui va être chargé, auprès des services britanniques spécialisés, de mener en Norvège, depuis Londres, la bataille de l’eau lourde…
Einard Skinnarland est un garçon robuste au regard franc. D’un coup d’œil Tronjstadt l’a jugé: c’est l’homme qu’il lui faut. .
– Vous avez rejoint, lui dit-il, les forces norvégiennes libres en Angleterre, maintenant, vous allez repartir pour la Norvège. Là-bas, vous serez l’agent de liaison entre les Résistants de l’usine de Rjukan et nos services de Londres. Sur place, vous préparerez l’avenir. Un jour, peut-être vous verrez arriver d’autres Norvégiens eux aussi envoyés par moi. Tenez-vous prêt.
L’usine de Rjukan ? Einard la connaît bien, il est né près du lac dont les eaux l’alimentent.
Deux jours plus tard, il est de nouveau assis à la table de famille. A quelques kilomètres de là, il a enfoui son parachute sous un tas de neige. Il sourit sans répondre lorsque son grand-père, qui ne sait pas d’où il vient, lui reproche de rester indifférent à l’avenir de la Norvège envahie… Par contre, son frère comprend tout d’un seul coup lorsque Einard, avec un clin d’œil, lui offre une cigarette anglaise : la famille Skinnarland va compter maintenant deux soldats de la Résistance norvégienne.
Les quatre de « Swallow »
Sur le bureau du Professeur Tronjstadt, le dossier de l’usine de Rjukan s’est gonflé de semaine en semaine. Désormais les Alliés savent tout ce qu’ils désiraient savoir.
En juillet 1942, Churchill donne l’ordre de frapper un grand coup, de préparer le sabotage de l’eau lourde. L’opération, si tout va bien, se déroulera en deux temps : d’abord un corps franc norvégien partira en avant pour préparer minutieusement l’intervention. Quand tout sera au point, vingt-cinq parachutistes britanniques rejoindront le corps franc en Norvège. Et ce sera le sabotage.
Le 15 octobre 1942, à onze heures trente du soir, deux officiers et deux sous-officiers (en civil) de l’Armée Norvégienne Libre, sautaient en parachutes au-dessus de leur pays natal et se posaient sur les premières neiges des montagnes du Télémarck. Leur chef, Jens Poulsen, est un sous-lieutenant de vingt-cinq ans, sorti de l’Académie Militaire d’Oslo. Les quatre hommes sur les contrôles de Londres répondent à l’indicatif « Swallow ».
Ils ont pour mission de s’installer comme ils le pourront dans la montagne, d’y vivre comme ils pourront, aussi longtemps qu’il le faudra. Avant tout, ils doivent entrer en contact avec Einard et assurer la liaison régulière par radio avec Londres, grâce au poste émetteur qu’ils ont amené. Ce dernier point est capital : pour que l’opération projetée ait quelque chance de réussir, il faut que Londres soit tenu au courant de ce qui se passe à l’usine de Rjukan, et dans ses environs, non plus seulement par des courriers passant par la Suède, mais jour par jour, et s’il est nécessaire, heure par heure.
Ils sont là, dans les solitudes de la montagne, en face d’une tâche démesurée, mais bien résolus à triompher. Ils connaissent la région; ils savent ce qui les attend.
Le beau temps qui les a accueillis à l’arrivée ne dure que quelques jours. Dès le 21 octobre, une violente tempête de neige annonce la venue de l’hiver; l’implacable hiver de la haute montagne norvégienne, qui va durer six mois, traînant derrière lui son cortège de blizzards, d’ouragans, de températures de plus en plus basses.
Le point qu’ils doivent atteindre afin d’y installer leur base d’opérations à proximité de l’usine même, est à 150 kilomètres du lieu où ils sont tombés avec leurs containers. Cent cinquante kilomètres qu’ils vont devoir couvrir par leurs propres moyens, dans des conditions qui, dès les premiers pas, se révèlent épuisantes.
Première difficulté : les Allemands ont brûlés presque toutes les huttes de montagne pour rendre la région inhabitable, en prévision, précisément, d’une tentative de coup de main comme celle qu’ils préparent eux-mêmes.
Le problème du chauffage, ensuite. Les poêles parachutés ne valent rien ; ils auraient été bien utiles pourtant avec leur système à brûler la paraffine. Le bois est rare, surtout à l’altitude où les quatre hommes avancent péniblement.
Le poids de leur équipement est écrasant : 240 kilos. Ils n’ont pas de traîneaux. Comme ils ne peuvent porter sur leurs épaules que 120 kilos à la fois, ils sont contraints de revenir sur leurs pas pour emmener le reste ; ils multiplient donc par trois les 150 kilomètres à parcourir.
Ils n’ont que trente jours de vivres. Les rations sont faites de viande séchée, de biscuits, de sucre, de farine et de lait en poudre. Le chef, Jens Poulsen, les a réduites au minimum en prévision d’une solitude qui durerait plus de trente jours.
La neige est mauvaise: elle se met en grumeaux sous les skis.
L’eau des marais, des fondrières, des cours d’eau n’est pas encore entièrement prise : chaque soir voit arriver à l’étape quatre hommes trempés jusqu’au ventre.
Et, pour comble de malchance, l’opérateur de radio n’a pas encore réussi à faire marcher son poste : le contact avec Londres n’est pas établi.
Le 24 octobre, il y a neuf jours qu’ils sont arrivés dans une ferme inhabitée, ils trouvent de la viande : pour la première fois, ils mangent à leur faim.
Ils sont à plus de mille mètres d’altitude; quand un coup de tempête fait voler la neige, le vent souffle parfois à 80 kilomètres à l’heure. Et cette radio qui ne marche toujours pas…
Une hutte, base d’opérations
Quand leur procession de fantômes blancs se fut traînée pendant 14 jours, ils trouvèrent enfin une hutte.
Jens Poulsen fait le point : cette hutte sera leur base d’opération ; ils sont maintenant assez près de l’usine de Rjukan.
A peine arrivés, l’opérateur de radio est déjà au travail, il a placé son casque d’un geste las: tant d’échecs successifs ne l’incitent pas à l’enthousiasme. Mais son visage s’éclaire. Ses trois compagnons se penchent vers lui. Victoire. L’indicatif de Londres a crépité contre les plaques. Et puis, le silence absolu. Les accus sont morts : ils sont tombés trop souvent, avec leurs porteurs, dans la neige à demi fondue.
L’un dès deux sous-officiers, Claus Helberg, natif de Rjukan, reçoit de son chef la mission de descendre un peu plus vers le sud pour y chercher de nouveaux accu; un peu plus au sud, en effet, à quelques kilomètres de l’usine, il y a l’amateur de cigarettes anglaises le frère d’Einard Skinnarland. Lui fera tout, on le leur a dit à Londres avant le départ, pour les aider. ..
Chasse à l’homme…
Claus Helberg part de bonne heure, le lendemain. C’est un bon skieur, il est décidé à faire vite. Ce jour-là, il fait un temps admirable, la lumière vole et scintille du ciel limpide et bleu à la neige vierge. Claus va comme le vent dans la chanson menue des skis qui glissent sans effort.
Sur l’immense étendue blanche, sa silhouette est un point noir, à peine perceptible à l’œil nu. Mais elle est démesurément grossie par les jumelles prismatiques de l’officier de troupes de montagne allemandes qui conduit sa patrouille dans la région. Il fait signe à l’un de ses soldats : un champion olympique de ski, et la chasse à l’homme commence.
Claus à l’avantage dans les montées car il est plus robuste que souple, mais l’autre gagne à toutes les descentes jusqu’au moment où Claus, qui se sentait déjà serré d’un peu trop près, voit avec soulagement, par-dessus son épaule, que son chasseur vient de faire une chute catastrophique. Claus, par précaution; s’impose encore un long effort, de toute la vitesse dont il est encore capable après quatre heures de poursuite ; puis il reprend une allure plus modérée : ce soir, il lui faudra refaire la même course en sens inverse et en portant les accus neufs dans son sac.
…et duel à mort…
Il en est là de ses calculs, lorsqu’un impérieux commandement en allemand le glace d’angoisse. Comme la voix le lui a demandé, il lève les bras, se retourne et reconnaît son chasseur qui a dû le rejoindre par un raccourci, après s’être remis de sa chute moins grave que spectaculaire.
Mais déjà, Claus, d’une main qui ne tremble pas, a tiré .son revolver de son blouson. Il veut amorcer le tir le premier, car il est sûr… sûr que son adversaire est un peu trop éloigné.
L’Allemand tire une balle… deux balles… tout son chargeur, balle après balle. A mesure que la neige, irisée par le soleil se creuse en rigole sous l’impact, à quelques mètres de lui Claus compte calmement. Il sait combien de balles contient le pistolet de l’homme qui est en face de lui. Quand il a compté sept, un sourire un peu féroce détend ses traits.
En voyant ce sourire, l’autre comprend et pâlit. Il tente de fuir, de profiter à son tour de la distance. Trop tard. Claus, de toute la puissance de ses jarrets se jette en avant sur ses .skis. Un nouveau coup de feu claque dans le silence ensoleillé… Cette fois, Claus ne sera plus rejoint.
Le soir, il frappe à la petite maison de bois, au bord du lac, où habite le frère d’Einard. Celui-ci vient ouvrir. Claus murmure le mot de passe qu’on leur a donné à Londres… .
Depuis ce moment et jusqu’à la fin, le contact par radio avec Londres ne sera plus interrompu…
VI
Sur le bureau de Tronjstadt puis, sur le bureau de Winston Churchill, arrivent maintenant tous les jours et parfois d’heure en heure les bulletins d’informations radiotélégraphiés par l’opérateur du Corps franc « Swallow ».
Peu à peu, à la lumière des renseignements ainsi transmis, Londres reconstitue dans toute son exactitude la situation telle qu’elle se présente à Rjukan, autour de l’usine géante et à l’intérieur de la petite pièce à l’eau lourde.
Les officiers des « Combined Operations» apprennent ainsi coup sur coup que les Allemands sont plus que jamais sur leurs gardes, que la garnison locale vient de doubler ses effectifs, qu’autour de l’usine, les sapeurs allemands ont tendu un nouveau réseau de fils de fer barbelés.
Aussitôt, quelque part en Angleterre, un moniteur des troupes aéroportées britanniques se penche sur une maquette qui reproduit dans tous ses détails l’usine de Rjukan. D’une pince légère, il l’entoure d’un fil qui représente le barrage des barbelés, suivant point par point les indications données .par les derniers messages de Swallow.
– Ça devient de moins en moins facile, dit-il, mais il nous reste encore cette grille à deux battants qui lorsqu’elle est fermée, coupe en deux la voie de chemin de fer qui dessert l’usine ; le passage est sûrement par là.
Les vingt-cinq hommes auxquels il s’adresse et qui font cercle autour de lui épaules contre épaules comme dans une mêlée de rugby, sont les vingt-cinq hommes que l’Etat Major des « Combined Operations » a désignés pour aller faire sauter l’usine de Rjukan…
La grande expédition
Les revoilà tous les vingt-cinq, non plus en cercle, mais sur deux rangs qui se font face; ils ne sont plus debout, ils sont assis… assis dans un planeur. L’avion qui les tire survole déjà, dans la nuit opaque, les montagnes de Norvège. Le visage à peiné éclairé par le reflet phosphorescent des appareils de bord, le pilote se penche à droite et à gauche.
– J’ai fait le point. Il n’y a pas d’erreur possible, c’est là qu’ils devraient être, murmure-t-il entre ses dents.
Et ses yeux écarquillés ne voient rien à travers l’épaisseur de la nuit d’encre, fourrée de brouillard.
Au-dessous d’eux, à quelques centaines de mètres seulement, les hommes de Swallow tendent des torches de magnésium; voilà deux fois; que les avions et les planeurs .viennent tourner au-dessus de leur tête. Ils s’éloignent de nouveau: de plus en plus amorti, le ronronnement des moteurs s’éteint soudain et restitue à la solitude glacée où s’agitent encore les fantômes blancs de Swallow son silence tragique et désespéré…
Manqué !
Un moment après, à moins de 100 kilomètres de là, vers les premières échancrures des fjords norvégiens et des îles aux eaux poissonneuses, un grand éclair, .puis des flammes rougeoyantes viennent de percer la nuit.
*
L’un des avions et les deux .planeurs, rentrant vers la Grande-Bretagne après leur opération manquée, faute de visibilité, se sont écrasés et flambent. Il y a des morts, mais beaucoup de survivants blessés ou indemnes.
De la salle grillagée de l’hôpital, et des cellules humides où on les a enfermés, les pauvres « British » entendent claquer sur les dalles le martèlement des bottes de leurs geôliers allemands? Jusqu’au petit matin où l’on ouvre les cellules, où l’on fait lever de leurs lits les blessés encore grelottants de fièvre. .
Debout près de la fenêtre sans barreaux qui domine la cour de la prison, un officier allemand soulève un peu le bord d’un rideau. Le rideau retombe lorsque l’officier a entendu l’éclat mat, amorti par la neige, d’une double salve, qui soudain rougit un coin de la cour.
Il se dirige vers la carte que ses hommes ont trouvée sur l’un des parachutistes britanniques; un crayon rouge a cerné d’un trait gras le nom de Rjukan, mais ce qu’il ne sait pas alors c’est que l’assassinat dont il a donné l’ordre et qui a été, tout à l’heure, exécuté sous ses yeux, traînera un jour son Reich devant le Tribunal de Nuremberg…
Pour lui c’est encore l’atmosphère de la victoire. L’officier allemand satisfait d’avoir rempli sa mission de gardien de l’eau lourde, d’avoir impitoyablement puni ceux qui sans doute étaient venus pour la détruire, fait renforcer encore les mesures de précaution autour de l’usine.
Les quatre hommes de Swallow ont été prévenus. La nouvelle les a d’abord accablés, tout était prêt… mais l’espoir leur est revenu on leur a promis qu’une nouvelle tentative aurait lieu à la prochaine lune…
Mystère sur Rjukan
Au-dessous d’eux, dans les vallées qui rayonnent autour de Rjukan, le long des pentes où sont juchés les bâtiments de l’usine, l’Allemagne prend ses précautions. Un ennemi clandestin rôde autour de l’usine à l’eau lourde. Il a sûrement des attaches solides avec la population locale; il a peut-être même sur place des observateurs en armes qui épient, qui attendent le bon moment et qui, entre temps, gardent le contact avec les Alliés ?
Les postes d’écoute allemands enregistrent parfois d’insolites émissions. Un mystère menaçant plane sur Rjukan. Alerté par l’incident des planeurs, Hitler a donné des ordres précis. La Gestapo arrête tous les suspects y compris le frère d’Einard.
Joseph Terboven, Commissaire du Reich pour la Norvège et le général von Falkenhorst qui commande les troupes d’occupation s’assurent eux-mêmes, sur place, de la protection de l’usine ; on voit passer dans les petites rues de Rjukan leurs puissantes automobiles a fanion rouge, blanc et noir: Les bûcherons ou les gardiens de rennes croisent dans les sentiers de la montagne des patrouilles accompagnées de chiens loups.
Parfois, une grande lueur s’élève sur les hauteurs et une épaisse fumée noire ternit de ses spirales, pendant des heures, la limpidité du paysage: des Allemands ont mis le feu à un refuge.
Sans nouvelles de son frère, Einard se sent tous les jours un peu plus menacé, il n’ose plus garder ses contacts. Une nuit pourtant, entre deux patrouilles, il chausse ses skis et monte rejoindre les hommes de Swallow. Tous les renseignements qu’il apporte sont aussitôt transmis à Londres.
Par deux fois déjà, la lune a cru et décru dans le ciel du Télémarck. Mais rien n’est venu rompre l’exténuante monotonie de la vie de Swallow. Il fait plus froid que jamais. Les vivres sont de plus en plus rares. Un grand découragement s’est abattu sur les quatre hommes. Et cette solitude ! Ce sentiment lancinant de l’inutilité d’un effort pourtant surhumain qui dure, qui dure…
Le chef Jens Poulsen note :
« Décembre. Les hommes sont malades; la fièvre, et ils souffrent aussi de l’estomac. Les vivres sont épuisés. Plus d’autre solution que le renne. Le radio a découvert un fusil de chasse et des cartouches. Il n’a encore rien tué. Il n’y a plus de bois sec. »
Le lendemain, le radio, parti comme tous les jours pour abattre un renne, revient avec… un poisson, un poisson séché qu’il a volé dans le garde-manger d’un refuge inhabité. Mais pour des hommes comme ceux-là, le découragement ne dure pas. Les informations à transmettre à Londres se font .rares. Le chef envoie Helberg aux nouvelles à Rjukan même. Helberg:est tout désigné pour cette mission périlleuse puisqu’il est né dans l’une des maisons de bois de la petite ville et que l’ingénieur de l’usine qu’il va contacter habite la maison voisine de celle-là, où vivent encore son père et sa mère.
Nuit de Noël
Cette fois, c’est la bonne lune. Londres, informé par l’émission que Swallow lui a faite, après la descente de Claus Helberg à Rjukan, prévient les quatre solitaires de l’arrivée des renforts.
Tout s’est bien passé. Helberg va remonter, chargé de renseignements vers la hutte qui sert de base au corps franc de Swallow. Il fait nuit. A tâtons, il se dirige entre les troncs des bouleaux autour desquels il jouait enfant. Il se rappelle, bien sûr, que les ordres sont formels, qu’en dehors des contacts, comme celui qu’il vient de prendre, il faut fuir la population qui, pour bienveillante qu’elle soit, doit ignorer l’existence de cette petite troupe en armes qui attend son heure pour fondre sur l’eau lourde.
Et pourtant, appuyé à un arbre, Claus, un vague sourire aux lèvres, regarde au travers la fenêtre de la salle commune (la Norvège n’a pas de black-out), la silhouette familière de sa mère qui va et qui vient autour de la table et près de la cheminée.
C’est l’avant-veille de Noël. Claus voit le petit arbre traditionnel chargé de givre et de paillettes d’argent. Sur le mur orné d’une branche de houx, il ya la photographie du Roi Kaakon.
Claus regarde et tout d’un coup, s’arrache à cette douceur, à cette lumière, Swallow doit émettre avant le lever du jour…
Nuit de Noël, réveillon, bonne humeur, vieilles chansons.
Jens Poulsen note : « Le temps s’est levé. On a pu enfin tuer un renne. Nous avons passé un bon Noël. »
VII
Cette fois, il ne s’agit plus de troupes aéroportées britanniques. Il s’agit d’un nouveau corps franc norvégien, composé de six hommes, eux aussi volontaires de la Compagnie « Linge », Corps d’élite des Forces Norvégiennes Libres entraînées en Angleterre. Si le premier s’appelait SwalÎow, le second va répondre à l’indicatif : « Gunnerside »
Ceux de Gunnerside
16 février, minuit. A une cinquantaine de kilomètres de la hutte qui sert de base d’opérations à Swallow, le vrombissement d’un avion éveille les échos de la haute montagne. Dans la nuit, glissent du ciel six masses blanches et soyeuses curieusement lestées par une forme indistincte.
Les six hommes de Gunnerside font une dernière culbute dans la neige poudreuse, ils sont en Norvège. Ils enterrent leurs parachutes et partent à tâtons à la recherche de Swallow qui, de son côté, tente de les découvrir dans l’immensité blanche où s’ensevelissent rapidement les dérisoires points de repère.
Ceux de « Gunnerside », au départ, sont plus chanceux que les quatre de Swallow. Eux, au moins, ont été lancés avec deux petits traîneaux. Ils ont l’équipement et l’armement ordinaires. Mais en plus, ils ont des explosifs : les explosifs, qu’on leur a confiés pour faire sauter l’usine de Rjukan.
La tempête de neige qui sévit depuis leur arrivée est si violente, que, pendant quarante-huit heures, ils ne peuvent pas sortir de la hutte où ils s’abritent. Ces hommes, passés brusquement du climat doux de l’Angleterre aux dures brûlures du froid de la haute montagne, tombent malades: bronchites et terribles engelures. Leur état s’aggrave, tandis que dehors, la tempêtes se transforme en ouragan, en blizzard dont les furieux coups de vent chargés de cristaux de neige; piquent, brûlent la peau, gercent et déchirent les lèvres et les paupières.
Et toujours à tâtons, vaguement guidés par Londres, Swallow et Gunnerside se cherchent et ne se rejoignent pas. Jusqu’au jour – neuf jours après le parachutage de Gunnerside – où ils se réveillent pour découvrir que le soleil rayonne dans un ciel éclatant et que la neige apaisée scintille doucement. Le chef de Gurinerside, Joachim Holmho Ronneberg note : « En approchant du village de Kallund, nous voyons venir droit vers nous deux skieurs inconnus. Je donne l’ordre à l’un de mes hommes de revêtir le grand manteau blanc de camouflage, de se coiffer d’un bonnet de civil. Il part pour prendre contact avec les deux hommes. Si ceux-ci l’interrogent, il répondra qu’il est gardien de rennes et qu’il fait la tournée de ses troupeaux. Nous nous cachons dans lès fourrés. Les deux hommes sont des hommes de Swallow » .Gunnerside et Swallow ne forment plus qu’un corps franc.
Dix hommes résolus
L’eau lourde allemande est en danger. Dix hommes résolus, commandés par CHURCHILL, vont affronter le Reich sur le champ de bataille immaculé de neiges et des laboratoires… Les rouleaux d’explosifs sont prêts.
C’est le moment où, en Europe occupée, Hitler et ceux qui font sa propagande, parlent de plus en plus des armes secrètes qui « bientôt vont faire leur apparition ».
L’avenir va donc dépendre pour une bonne part de ces neuf hommes qui, maintenant que la nuit est tombée en cette soirée du 27 février 1943, descendent silencieusement vers la vallée de Rjukan.
En face d’eux, mais sur le versant opposé, ils distinguent l’usine géante entourée de ses vapeurs, percée de ses vives lumières. Leur chef – le lieutenant Joachin Ronneberg – les arrête, un instant. Ils se débarrassent de leurs vêtements blancs. Et les voilà en uniformes. Ce soir, comme ils partent à l’attaque, ils ont voulu se battre à découvert…
Au-dessous d’eux, un peu à gauche, ils distinguent les lumières des petites maisons de bois de Rjukan. La nuit est assez claire. Les souffles du vent seraient imperceptibles si, en descendant la vallée, ils ne faisaient pas longuement vibrer comme des cordes de contrebasse les filins métalliques tendus d’un versant à l’autre et qui forment les mailles du filet destiné à empêcher les bombardements en piqué…
Pour les neuf hommes, les difficultés vont commencer. Jusqu’ici, ils sont descendus de la haute montagne, de toute la vitesse de leurs skis, grisés par la joie sportive, éblouis par le plaisir de faire tourbillonner la neige en une magique fantasia blanche, de baigner dans le froid vif et sain de la nuit transparente… Désormais, il s’agit de descendre le long des flancs lisses d’une falaise à pic et glissante, puis de remonter le long d’une autre falaise semblable, au faîte de laquelle tout en haut, ils trouveront la ligne de chemin de fer qui dessert l’usine et qui doit leur fournir le seul moyen de pénétrer jusqu’à elle. Il y a bien la souple passerelle suspendue qui enjambe la vallée, mais c’est là que les Allemands ont établi le principal poste de défense extérieure de l’usine.
La descente commence. Ils sont peu chargés : quelques armes légères au ceinturon ou en bandoulière, de quoi manger un peu au cours de route, les explosifs, des lampes électriques et quelques outils.
Le chef de l’expédition l’a racontée de la façon suivante dans le rapport officiel qu’il a ensuite adressé à Londres :
« A 10 heures, glissant et trébuchant, nous commençons à descendre vers la rivière (qui coule au fond de la vallée et qu’ils devront donc traverser pour atteindre l’autre versant). La débâcle est déjà amorcée ; il n’y a plus qu’un seul point de neige praticable, mais il est recouvert de plus de dix centimètres d’eau. Nous grimpons ensuite le long de la falaise abrupte et rocheuse qui forme la rive opposée… »
Avalanche !
En file indienne, le corps collé contre la paroi rocheuse, ils montent lentement. Dans la nuit maintenant claire, ils aperçoivent et entendent les soldats en armes du poste de garde de la passerelle suspendue. A mesure qu’ils s’élèvent, les bouffées du vent leur apportent, à travers l’ahanement essoufflé de leur propre respiration, le ronflement doux et rythmé des machines huilées de l’usine géante.
Soudain, tous ces bruits infimes ou lointains sont dominés par la chute sonore et rebondissante d’un rocher que l’un des neuf hommes vient sous son poids d’arracher à la falaise. Tous retiennent leur souffle : la marche cadencée des sentinelles allemandes sur la passerelle s’est arrêtée. Des ombres se penchent par-dessus le parapet et cherchent à découvrir l’origine du bruit insolite.
L’ascension reprend. Un dernier effort, un rétablissement sur les poignets : les neuf hommes ont atteint la ligne de chemin de fer.
Joachim Ronneberg note : « Nous progressons jusqu’à 500 mètres de la grille qui coupe, en se fermant, la ligne de chemin de fer desservant l’usine. Le vent d’ouest nous apporte faiblement le halètement des machines. Nous allons attendre là sans bouger jusqu’à minuit et demie. »
VIII
L’attaque est fixée à minuit et demie, c’est-à-dire quelques minutes après la relève, qu’ils voient se faire au-dessous d’eux, de la garde sur la passerelle.
Ils ont repéré l’étroit passage le long de la voie ferrée ou des traces de pas prouvent qu’il n’y a pas de mines. Ils sont prêts. Serrés les uns contre les autres, ils se rappellent les consignes. Le mot de passe, s’ils ont à se reconnaître dans l’obscurité ou dans la confusion d’un corps à corps : « Piccadilly…Leicester Square ». Ils se diviseront en deux groupes ; le groupe d’action composé du chef de l’expédition et de deux hommes et le groupe de protection qui, comme son nom l’indique, couvrira l’attaque. – Quand l’opération sera en cours d’exécution, liberté de manœuvre et initiative complète. Toute personne non allemande rencontrée sur les lieux devra selon les circonstances, être traitée avec la détermination requise. Ils ont tous pris l’engagement de se tuer s’ils voient qu’ils vont tomber aux mains de l’ennemi…
La nuit n’est plus animée dans le silence universel que par le doux ronflement des machines de l’usine. Au rez-de-chaussée, sous la masse des sept étages de béton et d’acier l’objectif ; une petite pièce où luisent des tubes d’acier et où l’eau lourde se concentre lentement, destinée aux laboratoires allemands qui préparent la bombe atomique.
Cette fois, c’est un claquement de tenaille qui a rompu le silence de la nuit ; deux hommes du groupe de protection, partis les premiers, viennent de broyer la lourde chaîne et le cadenas de la grille qui coupe la ligne de chemin de fer.
Une main légère remonte le long de chaque battant : pas de fil électrique. La route est ouverte. Le sabotage de l’eau lourde a commencé.
Dans l’usine
Avec une précision d’horlogerie, les neuf hommes courent sans bruit dans la cour de l’usine. Les hommes du groupe de protection se placent en chacun des points qui leur a été assigné sur le plan : entre leurs mains un peu crispées le canon des armes suit au jugé la direction suivie par les trois hommes du groupe d’action qui éprouvent la première entrée possible vers la petite pièce à l’eau lourde. Pas de succès : la porte, fermée de l’intérieur, est lourdement barrée… Ils se dirigent, toujours dans le même fantastique silence, vers la deuxième entrée.
Le gémissement d’une porte mal huilée se fait entendre à côté d’eux. Comme s’ils étaient foudroyés par un charme, les neuf hommes s’immobilisent en même temps, suspendant le geste commencé dans le rai de lumière que jette sur la neige la porte qui vient de s’ouvrir. Un soldat allemand passe la tête d’abord, puis tout le corps. Il promène jusqu’au milieu de la cour le faisceau d’une grosse lampe électrique. Le sommet de l’arc lumineux ainsi décrit s’arrête par bonheur à quelques centimètres des semelles ferrées du plus proche des neuf hommes.
La porte gémit de nouveau et se ferme. Dans l’ombre, le charme est rompu : les neuf hommes reprennent leurs mouvements ou leur pose. La deuxième porte est elle aussi inaccessible. Le temps presse. Suivi d’un de ses hommes, le chef de l’expédition qui est aussi le chef du groupe d’action, s’élance vers le troisième accès, le moins aisé. Joachin Ronneberg écrit dans son rapport :
Nous atteignons l’eau lourde
« Nous n’avons pas pu ouvrir la deuxième porte. Mais par la fenêtre de la petite pièce, j’ai aperçu, de dos, un homme Immobile. Nous nous mettons à chercher le dernier accès possible : le tunnel qui, dans la muraille extérieure, donne passage aux câbles électriques. Après les deux premiers échecs, c’est désormais notre dernière chance d’accès dans la petite pièce à l’eau lourde. Ce faisant, nous nous égaillons. Finalement, je trouve le tunnel. Suivi d’un seul de mes hommes, je m’y glisse au milieu des câbles enchevêtrés. Par un trou, dans la paroi, j’aperçois à ma gauche l’objectif. Il ne s’agit plus de perdre une minute : l’homme qui m’accompagne et moi, nous allons accomplir la mission tout seuls. Nous sommes maintenant dans une pièce adjacente à l’objectif. La porte qui, de cette pièce, ouvre sur celle où se concentre l’eau lourde est ouverte. Nous entrons. Le veilleur de nuit n’en croit pas ses yeux.
« Mais, il se tient tranquille… Je commence à placer les charges explosives… Soudain, derrière moi, j’entends un bruit de verre brisé. Je lève les yeux, quelqu’un vient de crever la vitre de la fenêtre qui ouvre sur la cour : une tête d’homme s’y encadre et regarde. C’est un de mes hommes qui n’ayant pas trouvé le tunnel des câbles a décidé de sa propre initiative de passer par la fenêtre. Il m’aide à placer les charges. »
Victoire !
« Dehors, pas la moindre trace d’alerte. Pourtant la protection de l’usine, outre les postes de garde, les sentinelles et les veilleurs comporte un dispositif sonore et lumineux qui peut en une seconde déclencher le hurlement des klaxons et la ronde des faisceaux de projecteurs.
Dehors, les mains un peu plus crispées, sur le canon et sur la gâchette, le groupe de protection scrute la nuit.
Nous allumons les deux mèches, nous quittons la petite pièce.
Nous sommes à vingt mètres d’elle, lorsque l’explosion se produit.
Nous repoussons la grille et nous suivons la ligne de chemin de fer. Un instant; je regarde en arrière, par-dessus mon épaule et j’écoute. Tout est encore tranquille ; j’entends seulement comme tout à l’heure en venant, le halètement des dynamos. »
Mais tout d’un coup, le silence est déchiré par le hululement des sirènes : la nuit est percée par les projecteurs qui s’allument aux quatre coins de l’usine. Trop tard ! 1.500 kilos d’eau lourde, la partie la plus importante des engins de fabrication, viennent d’être anéantis par les explosifs.
Les neuf hommes de Gunnerside et de Swallow, ont réussi cet exploit. Neuf seulement, en effet : les deux autres sont restés dans la montagne, pour garder le contact par radio avec Londres.
C’est à eux que revint l’honneur d’annoncer là-bas, le résultat du sabotage.
L’élan de l’Allemagne dans sa course aux armes secrètes était suspendu, au moins pour un certain nombre de mois…
Mission remplie !
Quelques jours plus tard, les onze hommes de Swallow et de Gunnerside se séparaient. Sur .la neige qui les avait vus, une nuit descendre du ciel en parachute, neuf allaient partir pour la Suède, puis l’Angleterre. Mais deux allaient demeurer sur place, garder le contact avec Londres, se tenir prêts, toujours dans le froid, toujours dans la solitude, toujours avec la faim au ventre – à répéter l’attaque s’il était nécessaire.
Tandis que dans le désert blanc de Télémarck, ils se séparaient ainsi, non loin d’eux et dans la vallée, l’Allemagne prenait des mesures nouvelles de protection et de représailles. .
L’ennemi invisible avait frappé une nuit, en pleine surprise et il avait magnifiquement réussi son coup de main. Mais l’Allemagne conservait la source de l’eau lourde; elle entendait intensifier son effort et réparer en quelques mois les dégâts causes par le sabotage du 23 février.
Le vacarme assourdissant des 80 forteresses volantes tournoyant au-dessus de Rjukan et bombardant en piqué l’usine géante donna la preuve, à la mi-novembre 1943, que les Alliés, fidèlement informés par la radio des deux solitaires de Télémarck, jugeaient de nouveau importante .la production de l’eau lourde.
IX
Dans le refuge où ils sont installés et d’où partent tous les jours les messages en code, Eynar et Knut – les deux hommes demeurés sur place, – devisent paisiblement, comme ils font souvent dans leur interminable tête-à-tête.
Un coup de poing frappé contre la porte les fait sursauter. Mais c’est un ami qui vient les visiter : l’ingénieur Sorlie qui, de l’intérieur même de l’usine, les tient au courant de tout ce qui s’y passe : « Ils » viennent de prendre une, décision inouïe, dit-il d’une voix encore essoufflée par la course dans la montagne: « Ils » ont décidé de faire partir l’eau lourde pour l’Allemagne !…
Un dialogue dramatique
La nouvelle est, en effet, sensationnelle. Pour les deux hommes qui la recueillent des lèvres du fidèle Sorlie, elle signifie qu’enfin, quelque chose va se passer, que leur vie de Robinson des Glaces et des Neiges va prendre un tour plus actif, plus dramatique aussi sans doute.
Pour Londres, Winston Churchill et le professeur Tronjstadt, cette nouvelle que viennent de capter les grandes antennes métalliques de la B.B.C, signifie que la « Bataille de l’Eau .Lourde » s’engage dans sa phase décisive : si des ordres formels viennent d’arriver de Berlin, si l’Eau Lourde de Rjukan doit partir sans délai pour le Reich, c’est que les laboratoires du Reich sont décidés à l’utiliser.
Entre la petite antenne des neiges, soutenue par deux bâtons, de skis et les bras immenses des antennes réceptrices d’Angleterre, s’établit un dialogue précipité :
« Le stock qui va partir pour l’Allemagne, précise l’émetteur perdu dans les solitudes du Telemark, est un stock de dix mille litres, résultat de deux ans d’effort sans cesse intensifié malgré la résistance des ouvriers et de la Direction de l’usine, malgré sabotages et bombardements. »
Dans son bureau londonien, le professeur Tronjstadt suppute la valeur de ces dix mille litres : « leur destruction, suspendrait pendant des années les recherches atomiques du Reich. ».
Et pourtant, le Reich ne tient à rien tant qu’à poursuivre, au contraire, ses recherches atomiques. Poursuivre ? Peut-être atteindre le but…
Hitler vient de hurler quelque part en Allemagne: « Dieu me pardonne les huit derniers jours de la guerre. ». A Radio – Paris, Jean-Hérold Paquis vient de lancer la fameuse- formule : « L’Angleterre, comme Carthage, sera détruite:.. »
La petite antenne autour de laquelle attendent, anxieux, Eynar, Knut et SORLIE ajoute : « Ce n’est pas seulement l’Eau Lourde qui va partir, c’est aussi tout son matériel de fabrication. »
Londres répond : « Détruire convoi, coûte que coûte, par tous les moyens. »
Instantanément Knut soumet un plan à Londres qui accepte et ajoute: « Ordre impératif de succès. »
Nouvelle attaque
Le plan est simple. Non loin de l’usine, dans la mansarde de la maison qu’habite Sorlie, les trois hommes sont réunis, Knut parle :
– J’ai fait cela, dit-il, avec les pièces d’un réveille-matin.
Et il montre quelque chose qui a encore l’air en effet d’un réveil mais qui est un mécanisme d’horlogerie, destiné à commander, les charges explosives. .
Knut ajoute :
– J’ai calculé que les charges sont assez puissantes pour détruire le convoi en quatre ou cinq minutes…
Le plan de Knut consiste tout simplement à couler le ferry-boat sur lequel, dans quelques heures, demain matin, vont être transbordés l’Eau Lourde et son matériel de fabrication.
Knut dit encore :
– Cet après-midi, j’ai traversé le lac sur le ferry-boat qui va servir demain. J’ai calculé qu’à dix heures quarante-cinq il se trouvera sur des fonds de trois cents mètres.
C’est le 19 février 1944, presque un an jour pour jour, après le sabotage par les hommes de Swallow et de Gunnerside, de la petite pièce à l’Eau Lourde au fond de l’usine géante…
Rjukan et ses environs ont vu arriver de nouvelles troupes allemandes, en particulier des S.S. et de la Gestapo, venues pour assurer la protection du convoi depuis l’usine jusqu’à la mer.
L’itinéraire que suivra l’Eau Lourde sera le suivant : le train quittant l’usine descendra à travers Rujkan jusqu’au lac où les wagons contenant l’Eau Lourde et le matériel de fabrication, passeront à bord du ferry-boat « Hydro ».
Au delà du lac, le train se rendra jusqu’au port maritime d’embarquement ; de là, l’Eau Lourde terminera son voyage jusqu’au Reich par mer…
X
Il est 10 heures du soir; la nuit est épaisse. De temps en temps des projecteurs promènent lentement leur pinceau de lumière sur les abords de l’usine et sur la vallée. Tout le long de la voie ferrée, sur laquelle le train va rouler, tout à l’heure depuis l’usine jusqu’au lac, il y a des sentinelles tous les cinquante mètres ; les patrouilles circulent dans Rjukan et sur les routes alentour.
Jusqu’à la tombée de la nuit, des avions de reconnaissance ont survolé la région. L’Allemagne protège son Eau Lourde…
Une heure du matin : les trois hommes qui tout à l’heure devisaient dans la mansarde de SORLIE, chacun portant un sac, descendent dans la cour de la maison où les attend un taxi dont le chauffeur, un Résistant comme eux, s’est fait octroyer par les Allemands (Dieu sait comment) un Ausweis de nuit. Tout de suite, le taxi se met en route vers le lac.
Par la glace baissée, Knut et ses compagnons aperçoivent le train, la garde qui entoure ses wagons, les sentinelles qui jalonnent les rails. Dans la petite, gare de bois qui dessert l’embarcadère du lac, à une centaine de mètres du bord de l’eau il y a encore des sentinelles.
A bord de l’ « Hydro »
Le taxi avance toujours. Sur un signe de Knut le chauffeur s’arrête, un peu en retrait ; l’ordre lui est donné de rester au volant et de laisser son moteur en marche. Ouverte sans bruit, la portière du taxi laisse passer les trois hommes qui, à pas de loup, mais prêts à passer coûte que coûte, s’approchent, la main serrée sur le manche du poignard, de l’embarcadère où’ est accosté le ferry-boat « Hydro ».
Ils sont déjà au bord de la passerelle et, de là, ils découvrent tout l’embarcadère, et les deux, ponts du ferry-boat.
Nulle part, il n’y a de sentinelles allemandes. Ils se regardent stupéfaits mais reprennent aussitôt leur marche. Les voilà à bord du ferry-boat, ils entendent à l’intérieur du navire l’équipage norvégien qui joue aux cartes. Knut et ses deux compagnons descendent vers le pont où se trouve le salon des passagers.
Knut écrit dans son rapport : « Laissant un de mes hommes dans le salon, je passe avec l’autre par une trappe. Suivant la quille, nous nous dirigeons à tâtons vers l’avant, c’est là que je place mes charges d’explosif. »
En réalité, l’opération est laborieuse. Il faut éviter autant que possible de se servir des lampes électriques; il faut éviter surtout de faire le moindre bruit. Et ils sont là, tous les deux, en équilibre instable sur les membrures du navire, les pieds dans un mélange noirâtre d’eau et d’huile, qui fait glisser.
Knut regarde encore une fois le cadran qui porte l’heure fatidique : 10 heures 45. Quand ils ont fini, il est 4 heures du matin. Ils remontent par la trappe, rejoignent celui qu’ils ont laissé de faction dans l’ombre du salon des passagers. A peine l’ont-ils retrouvé, qu’une voix dit auprès d’eux, en norvégien:
– Mais que faites-vous ici à cette heure ?
C’est un veilleur de nuit, à qui Knut répond, jouant le tout pour le tout :
– Nous essayons de nous cacher, nous sommes poursuivis par la Gestapo.
– Eh bien, répond le veilleur, je vais vous donner une bonne cachette, mettez vous là. Et il désigne la trappe sous laquelle les explosifs viennent d’être placés.
– Merci, dit Knut, nous reviendrons un peu plus tard…
– Pas trop tard, le ferry-boat partira vers 10 heures et j’aurai quitté mon service.
Les trois hommes ressortent par le même chemin, franchissent la passerelle aussi vite qu’ils le peuvent. Il n’y a toujours pas de sentinelles allemandes. Ils retrouvent le chauffeur à son volant, avec le moteur qui tourne toujours au ralenti. Un instant plus tard, la voiture disparaît dans la nuit sans avoir attiré l’attention…
La bataille est gagnée
Le jour est venu. Dans le ciel limpide passent et repassent des patrouilles d’hydravions. Au bord du lac, le train de l’Eau Lourde vient d’arriver sur l’embarcadère, qui maintenant fourmille de sentinelles armées jusqu’aux dents. Dans un grand bruit de chaînes, les wagons passent à bord du ferry-boat. Les dix mille litres d’Eau Lourde sont en route pour le Reich. Bien loin de là, dans la montagne, Knut regarde le cadran de sa montre: il y a encore une heure :
– 10 heures 45 ! Pourvu que tout marche bien !…
D’ailleurs les Alliés ont pris des précautions supplémentaires. Au large de la côte norvégienne, devant le port d’embarquement, des sous-marins anglais sont prêts à intervenir.
Si l’Eau Lourde arrivait jusque-là !
Dans le calme de la matinée, sur laquelle brille un éclatant soleil, le ferry-boat « Hydro » trace lentement son sillage sur l’eau paisible du lac.
Sur sa montre, Knut lit : 10 heures 40, 10 heures 43, 10 heures 45… Son visage se crispe… Cependant, sur le lac il ne s’est rien passé.
10 heures 47, 10 heures 48, 10 heures50.
Une immense gerbe de feu suit une explosion assourdie, qui vient d’ébranler le ferry-boat de proue en poupe (fig. 2). En quelques secondes, l’avant qui s’enfonce rapidement est presque déjà sous l’eau. Une deuxième gerbe, plus haute encore que la première : les wagons contenant l’Eau Lourde et son matériel de fabrication, viennent de disparaître par trois cents mètres de fond.
Bientôt l’eau du lac retrouve son calme sous l’éclatant soleil de cette matinée de février 1944. La bataille de l’Eau Lourde était gagnée et l’Angleterre ne fut pas détruite comme Carthage…
Mais Knut, lui, fut très mortifié lorsqu’il apprit, beaucoup plus tard, que « son» explosion avait eu cinq minutes de retard…
V. CONCLUSION
Je laisse la conclusion de cette aventure héroïque à un scientifique allemand, Kurt Diebner, qui dit : « La destruction de notre production d’eau lourde en Norvège fut la principale raison de notre échec à la mise au point d’un réacteur en chaîne avant la fin de la guerre ».
Remarquons qu’il parle de la mise au point d’un réacteur et non d’une arme. Dans un prochain article, nous verrons où en était la recherche nucléaire en Allemagne et si les craintes des Alliés, à propos de la mise au point d’une bombe nucléaire allemande, étaient justifiées.
VI. QU’EST-CE QUE L’EAU LOURDE?
L’eau lourde ou, en terme savant, hémioxyde de deutérium (formule: D2O ou 2H2O), a été découverte en 1930, elle est formée d’un atome d’oxygène et de deux atomes de deutérium, isotope de l’hydrogène.
Le premier échantillon d’eau lourde pure fut isolé en 1933 par Gilbert Newton Lewis.
Le noyau de l’hydrogène ordinaire est formé d’un proton et a une masse atomique de 1. Il existe deux autres isotopes naturels de l’hydrogène : le deutérium et le tritium. En plus de son proton le noyau du deutérium renferme également un neutron. Il a donc une masse atomique de 2. Quant au tritium c’est un élément instable et radioactif dont le noyau possède un proton et deux neutrons. Il a une masse atomique de 3. Dans un volume donné d’hydrogène, on retrouve environ 0,02 % de deutérium. Ces atomes de deutérium peuvent se combiner avec l’oxygène pour donner de l’eau lourde, dont la densité est d’environ 11% supérieure à celle de l’eau ordinaire.
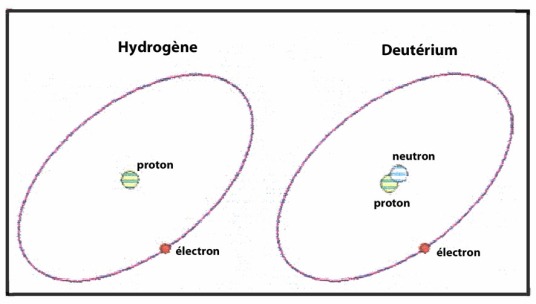
Fig. 1 – Comparaison entre atome d’hydrogène et deutérium
L’eau lourde a les mêmes propriétés chimiques que l’eau ordinaire. Quand aux propriétés physiques, l’eau lourde bout à 101,42 °C au lieu de l00 °C, et son point de congélation est de 3,81°C au lieu de 0°C.
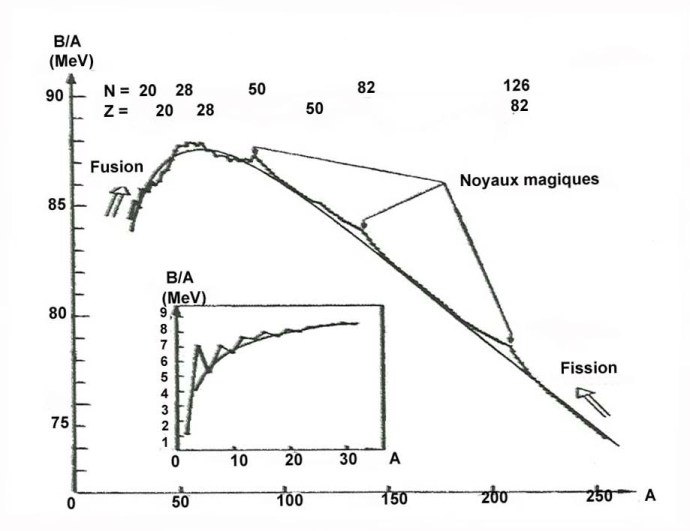
C’est le domaine de la fission nucléaire qui mit l’eau lourde en vedette. Elle est utilisée comme « modérateur » dans certains types de réacteurs : CANDU, réacteur à uranium naturel et à eau pressurisée. Rappelons qu’un modérateur sert à ralentir les neutrons libérés par la fission, favorisant ainsi la réaction en chaîne. On peut utiliser de l’eau ordinaire, mais l’eau lourde a l’avantage de moins capturer les neutrons. Certains modèles de réacteurs utilisent plutôt le graphite comme modérateur.
L’eau lourde est naturellement présente dans l’eau mais en très faible quantité : une molécule d’eau lourde pour 7000 molécules d’eau ordinaire. Il existe divers procédés de production d’eau lourde : par électrolyse et distillation de l’eau, distillation de l’hydrogène liquide, échange isotopique H2OH-H2S, échange isotopique NH3-H2. Dans le cas des échanges isotopiques, on exploite la différence d’affinité du deutérium et de l’hydrogène pour les différents composés. Ces procédés chimiques sont basés sur la différence de poids moléculaires qui produit une légère différence de vitesse à laquelle les réactions chimiques se produisent.
La première installation de production industrielle d’eau lourde a été réalisée en 1934, par la société Norsk Hydro qui s’est implanté à Vemork (Rukjan) en Norvège. Elle avait une capacité de production de 12 tonnes par an. Je vous ai raconté son histoire plus haut.
La plus grande partie de l’eau lourde utilisée en France, après la guerre, a été importée de Norvège et des États-Unis (selon certaines sources). Les réacteurs civils mis en service dans l’Hexagone avant 1967 auraient demandé 150 tonnes d’eau lourde au maximum. De l’eau lourde serait stockée à Saclay et à Cadarache.
Actuellement, ce sont surtout les Canadiens qui développent les réacteurs à eau lourde. J’en reparlerai lorsque j’aborderai la recherche nucléaire au Canada.
Un de nos lecteurs a posé la question de l’utilisation première de l’eau lourde. Malheureusement, je n’ai rien trouvé de précis. La seule référence à une utilisation autre que celle de modérateur est la suivante : 1931- utilisation de l’eau lourde (Deutérium) pour mesurer le contenu en eau du corps humain, selon le principe de dilution.
Par contre, elle est également utilisée actuellement pour la détection des neutrinos. Ainsi, l’Observatoire de Neutrinos de Sudbury SNO (Ontario. Canada) utilise 1.000 tonnes d’eau lourde dans une cuve enterrée dans une mine à plus de deux kilomètres sous terre afin d’être protégée des rayons cosmiques. Le SNO détecte l’effet Tcherenkov produit quand un neutrino traverse l’eau lourde.
VII. BIBLlOGRAPHIE
- Crochet Bernard, McNair Ronald – La bombe atomique Hiroshima – Nagasaki. Historica Hors série. juil-août-sept 1995.
- Gallagher Thomas – Halte à la bombe de Hitler, Selection du Reader’s Digest, mai 1976.
- Gueron Jules (1980) – Lew Kowarski et le développement de l’énergie nucléaire.
- Marin Jean – La bataille de l’eau lourde, in Lisez-moi Aventures, N° 1 – 15 mai 1948 et N° 2 – 1er juin 1948.
- http://perso.wanadoo.frlhydrolandlEauxDivers.htm
- Eau lourde in http://encyclopedie.snyke.com/articles/eau_lourde.html

Figure 2- Une immense gerbe de feu suit une explosion assourdie, qui vient d’ébranler le ferry-boat de proue en poupe.