Cet article est paru dans le Bulletin du G.E.S.T., N° 169, se septembre 2011
I. INTRODUCTION
La catastrophe nucléaire qui a ébranlé le Japon en mars 2011, remet en mémoire celle de Tchernobyl. Cet événement tragique fait le jeu des opposants de tous bord à l’utilisation de l’atome dans l’obtention de notre énergie électrique.
Depuis l’existence des centrales nucléaires dont la première remonte à 1951, il y a 63 ans, seuls trois accidents majeurs se sont produits. Chiffre dérisoire comparé à celui des incidents dramatiques qui ont touchés les autres domaines de l’industrie chimique, pétrolière, des transports maritimes, ferroviaires et routiers.
Le premier de ces accidents de l’histoire du nucléaire civil est celui de la centrale américaine de Three Mile Island, survenu le 28 mars 1979. Il sera suivi, 7 ans plus tard, de celui de la centrale de Tchernobyl, en Ukraine, dont un réacteur explose le 26 avril 1986. Enfin, le dernier en date, celui de Fukushima, dû aux conséquences du tsunami qui a suivi le séisme de magnitude 9 qui a ébranlé la grande île de Honshu au Japon.
La hantise d’une explosion nucléaire du type de celui des bombes lancées sur Hiroshima et Nagasaki et des campagnes de tirs qui ont émaillés les années 1950 à 1970 reste ancrée dans l’esprit de la population. Les radiations font peur ! Je renvois le lecteur à mon article, « Faut-il avoir peur du nucléaire ? » qui avait ouvert le dossier nucléaire paru en épisodes dans notre bulletin. Je ne vais pas rouvrir le débat ici, car cela nous entraînerait trop loin. Je veux simplement essayer d’expliquer ce qui différencie ces trois accidents.
II. HISTORIQUE
La première centrale nucléaire entre en service aux Etats-Unis, le 20 décembre 1951, au Experimental Breeder Reactor I (EBR-I) près de la ville d’Arco dans l’Idaho. Elle sera suivie, le 27 juin 1954, par une centrale civile qui est connectée au réseau électrique à Obninsk, en Union soviétique, avec une puissance de production électrique de 5 mégawatts. Ensuite, l’usine de Marcoule en Provence diverge le 7 janvier 1956, celle de Sellafield au Royaume-Uni est raccordée au réseau en 1956, et le réacteur de Shippingport aux Etats-Unis est connecté en 1957, tandis que les travaux de construction de la première centrale à usage civil française, à Chinon (EDF1), démarrent la même année. Depuis, le nombre de centrales nucléaires de par le monde a augmenté assez rapidement.
Ainsi, en 2011, après l’accident de Fukushima, et la décision des autorités japonaises d’arrêter définitivement les réacteurs Fukushima 1 à 4, le 20 mai de cette année, 440 réacteurs de puissance à usage civil fonctionnent dans 30 pays différents. 64 réacteurs sont actuellement en construction. Les Etats-Unis, la France, le Japon et la Russie disposent à eux quatre de 56% du nombre total de réacteurs dans le monde, soit 248.
III. RISQUE D’ACCIDENT
Il est évident que des études de sécurité ont été menées depuis le début de l’industrie nucléaire et qu’un certain nombre de règles a été édicté afin de respecter un taux de sécurité le plus élevé possible. Malheureusement, le coût de l’application de ces règles grève le prix du KW/h, entraînant parfois, de la part des exploitants, un relâchement des normes de sécurité.
L’accident majeur que craignent les ingénieurs est la fusion du cœur d’un réacteur nucléaire. Celle-ci survient lorsque les barres de combustible, qui contiennent l’uranium ou le plutonium, et les produits de fission, commencent à surchauffer puis à fondre dans le réacteur à la suite d’un défaut de refroidissement. Cet incident est considéré comme étant très grave, en raison de la probabilité que des matières fissiles puissent polluer l’environnement par émission de radio-isotopes hautement radioactifs.
L’objectif que s’était fixé la France pour ses centrales de première génération était d’avoir une probabilité de fusion du cœur inférieure à 5 sur 100.000 par réacteur et par an. Pour la deuxième génération, cette probabilité a été portée à 1 sur 100.000 dans un réacteur à eau pressurisé (REP) de 1.300 MWe² . Du côté allemand, « l’étude officielle sur les risques nucléaires, phase B » avance une probabilité de catastrophe majeure dans une centrale après 40 ans de fonctionnement de 0,1 %, ce qui correspondrait à 2,5 accidents par réacteur et par 100.000 ans de fonctionnement. Ce niveau de sécurité, au début 2009, était légèrement supérieur à la moyenne dans le reste du monde, l’industrie nucléaire ayant accumulé une expérience totale de 13.000 années x réacteur de fonctionnement.
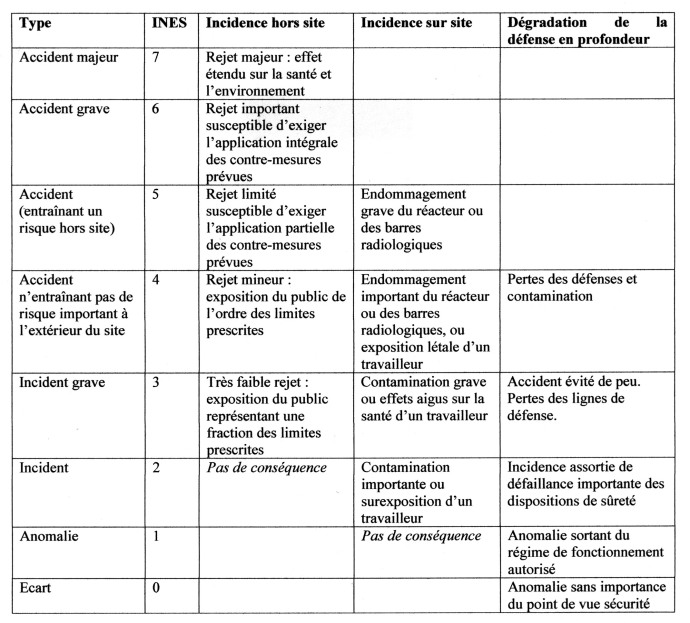
IV. ECHELLE INTERNATIONALE DES EVENEMENTS NUCLEAIRES (INES)
Afin de faciliter la perception par les médias et le grand public de l’importance des incidents et accidents nucléaires en matière de sécurité, l’autorité de sûreté nucléaire (ASN) a établi une échelle d’évaluation de la gravité des événements nucléaires (International Nuclear Event Scale). Celle-ci comporte huit niveaux de gravité notés de 0 à 7, selon une gradation logarithmique, un niveau correspondant à un facteur 10. C’est ainsi, que les accidents de Tchernobyl et de Fukushima ont été classés officiellement au niveau 7.
Les événements de niveaux 1 à 3, sans conséquence significative sur les populations et l’environnement, sont qualifiés d’incidents, les autres (4 à 7) d’accidents.
Trois zones d’incidences sont prises en considération pour analyser les événements en fonction de leurs conséquences : incidence hors du site sur les personnes et les biens, incidence sur le site, et incidence sur la défense profonde³.
A ce jour, l’industrie nucléaire a connu 2 accidents majeurs (7), un accident grave (6), 4 accidents entraînant un risque hors site, 5 accidents n’entraînant pas de risque hors site, et 7 incidents graves.
V. LISTE DES ACCIDENTS AYANT ENTRAINE LA FUSION DU COEUR
A ce jour, plusieurs accidents ayant entraîné la fusion partielle ou totale du cœur d’un réacteur se sont produits dans le monde, sans nécessairement atteindre le niveau d’une catastrophe environnementale.
- Le 10 octobre 1957, l’incendie dans la première centrale anglaise de Windscale (rebaptisée Sellafield), est jugé de niveau 5 sur l’échelle INES ;
- Le 17 octobre 1969, 50 Kg d’uranium sont entrés en fusion dans le cœur du réacteur A1 de la centrale française de Saint-Laurent-des-Eaux, lors d’une opération de chargement. A l’époque, cet accident a été qualifié de niveau 4 par EDF ;
- Le 28 mars 1979, se produit l’accident de la centrale américaine de Three Mile Island. A la suite d’une suite d’événements accidentels, le cœur du réacteur TMI-2 fond en partie. L’accident est classé au niveau 5 ;
- Le 13 mars 1980, la fusion de 2 Kg d’uranium du réacteur A2 de la centrale française de Saint-Laurent-des-Eaux, endommage gravement celui-ci qui sera indisponible pendant trois ans et demi environ. Cet accident est porté au niveau 4 et est le plus important en France ;
- le 26 avril 1986, l’explosion de la centrale soviétique de Tchernobyl a conduit à la fusion du cœur d’un réacteur et au relâchement dans l’atmosphère de produits radioactifs, entraînant de nombreux décès, survenus directement ou à la suite d’une exposition aux radiations. C’est le premier accident à être classé 7 sur l’échelle INES ;
- En 2011, l’accident de la centrale japonaise de Kukushima, estimé dans un premier à 4, puis à 5 pour finalement atteindre 7 sur l’échelle INES.
VI. TYPES DE CENTRALES
Les trois sites qui nous intéressent ici, à savoir Three Mile Island, Tchernobyl et Fukushima, sont équipés de centrales de types différents.
- Three Mile Island
Ce site était équipé d’un réacteur à eau pressurisée (REP). Cette technique de réacteur nucléaire dite de deuxième génération comporte deux circuits d’eau dont l’un refroidit le cœur du réacteur et transfère sa chaleur dans un échangeur au deuxième circuit, dans lequel l’eau se transforme en vapeur et fait tourner les turbines (fig. 1). L’eau du circuit primaire sert également de modérateur. Dans ce type de filière, l’eau ne bout pas dans le cœur du réacteur, car elle est à très haute pression, supérieure à la pression d’ébullition à la température de fonctionnement du réacteur. Le combustible nucléaire est de l’oxyde d’uranium enrichi à 3 à 5% d’235U, selon les pays. Il est distribué sous forme de pastilles empilées dans des gaines en zircaloy, appelées crayons.
L’avantage de cette technologie est que l’eau qui est en contact avec les barres de combustible ne quitte jamais l’enceinte métallique du réacteur, diminuant fortement le risque de contamination en cas de fuite radioactive.
Cette technologie, d’origine américaine (Westinghouse) est la plus répandue dans le monde en 2006. Les réacteurs qui en découlent, équipent la majorité des navires et sous-marins à propulsion nucléaire et la majorité des centrales de production d’énergie électrique.
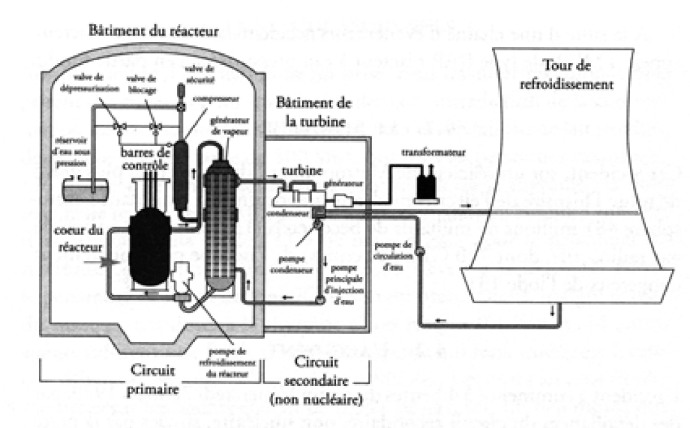
Fig. 1 – Réacteur REP de Three Mile Island
- Tchernobyl
A Tchernobyl, nous avons à faire à un réacteur graphite – eau bouillante (Reaktor Bolshoy Moshchnosti Kanalniy, RBMK) (fig. 2), de conception soviétique. Ce type de réacteur est destiné à la production industrielle d’électricité et à la production de plutonium. Il est refroidi à l’eau et modéré au graphite. Il permet d’utiliser de l’uranium peu enrichi comme combustible, soit 1,8% d’235 U contre 3% environ pour l’uranium utilisé dans les réacteurs classiques. Sa technologie nécessite un grand volume, 20 fois celui d’un REP. Pas de cuve sous pression, ni enceinte de confinement, mais un grand nombre de tubes contenant le combustible, placés verticalement dans l’empilement des briques de graphite, et appelés « tubes de force ».
Le réacteur de Tchernobyl comportait 190 tonnes d’oxyde d’uranium faiblement enrichi, réparti dans 1.681 tubes de force. L’eau circulant autour de ces tubes joue le rôle de réfrigérant et fournit directement la vapeur nécessaire à actionner les turbines. Le chargement et le déchargement du combustible se font en continu sans devoir arrêter le réacteur.
L’ensemble de ces diverses caractéristiques (eau bouillante, graphite, combustible peu enrichi, absorbants, etc.) confère à ce type de réacteur une instabilité à certains régimes de fonctionnement qu’il faut éviter à tout prix, notamment aux faibles puissances.
Les points faibles de ce type de filière sont de différents ordres :
– inflammabilité du graphite à haute température ;
– formation possible de bulles dans le fluide caloporteur dans certaines conditions de fonctionnement, entraînant un emballement de la réaction en chaîne ;
– omniprésence de l’eau, en tant que fluide caloporteur et absorbeur de neutrons ; sa vaporisation peut s’avérer dangereuse ;
– instabilité du cœur à basse puissance ;
– pas d’enceinte ni de dôme de confinement ;
– barres de contrôle d’une maniabilité insuffisante.
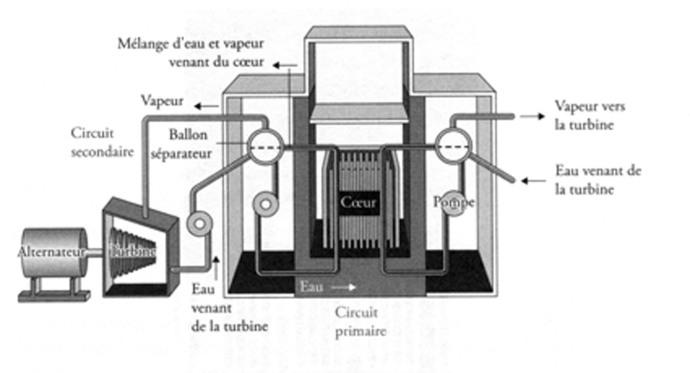
Fig. 2 – Réacteur RBMK de Tchernobyl
- Fukushima Daiichi
La plupart des centrales japonaises utilisent la filière des réacteurs à eau bouillante (REB) (fig. 3). Dans ce cas, le combustible nucléaire est immergé dans l’eau qui peut bouillir au-dessus du cœur du réacteur à une température et une pression élevées. La vapeur produite est envoyée vers une turbine dont la rotation entraîne un générateur électrique. La vapeur à basse pression sortant de la turbine est condensée dans un échangeur de chaleur qui transfert la chaleur excédentaire vers l’extérieur. L’eau condensée est récupérée par une pompe et renvoyée dans le circuit, où elle reprend son cycle.
Ce type de filière présente un inconvénient majeur : en cas de fuite radioactive celle-ci se propage dans la vapeur qui alimente les turbines et provoque une contamination externe.
Les réacteurs REB (BWR en anglais pour Boiling Water Reactor) sont utilisés dans plusieurs pays dont les Etats-Unis, le Japon, l’Allemagne, la Finlande, la Russie, la Suède et la Suisse. Cette filière vient en second après les réacteurs à eau sous pression (REP) et représente environ le quart du parc mondial des réacteurs en exploitation.
La conception de ce type de centrale à neutrons thermiques et dont le modérateur est l’eau ordinaire, est d’origine américaine et est restée longtemps du domaine du constructeur General Electric (GE). La première unité commerciale, conçue par GE, fut la centrale de Humboldt Bay, près de Eureka au nord-ouest de la Californie, et appartenant à la compagnie Pacific Gas and Electric. Elle fut exploitée de 1963 à 1976, année où elle fut arrêtée à la suite de la découverte d’une faille sismique et des risques potentiels, étant donné sa faible taille.
La puissance actuelle de ce genre de réacteur est de l’ordre de 570 à 1.300 MWe.
Comparé à la filière REP, il y a une barrière de moins dans les réacteurs REB entre le combustible radioactif et l’environnement. Cela nécessite un gainage du combustible particulièrement étanche et toute l’attention doit être porté sur ce point, ainsi que sur l’étanchéité des turbines. Donc dans ce type de réacteur, il y a trois barrières de confinement : la gaine du combustible, la cuve et l’enceinte de confinement.
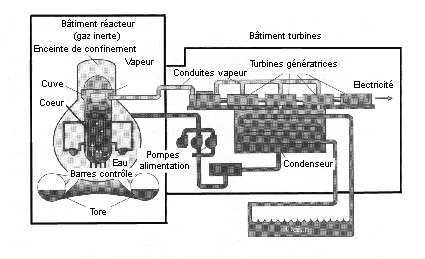
Fig. 3 – Réacteur REB de Fukushima
VII. L’ACCIDENT DE THREE MILE ISLAND
Le site, situé sur une île de la rivière Susquehanna, près de Harrisburg, dans l’Etat de Pennsylvanie, comprenait deux réacteurs à eau sous pression (REP) de 900 mégawatts (MW) : TMI-1 et TMI-2, de la firme Metropolitam Edison.
L’accident, sur le réacteur TMI-2, eut lieu le 28 mars 1979 et débuta à 4 h du matin. Ce fut le plus grave de toute l’histoire nucléaire civil des Etats-Unis.
Une succession d’événements accidentels, due à des défaillances techniques et humaines, amena la fusion d’une partie du cœur du réacteur et l’émission dans l’atmosphère de 481.1015 de becquerels4 , dont 740 GBq d’iode radioactif 131.
La série des incidents commença par une panne de deux pompes du circuit secondaire du réacteur TMI-2, entraînant une modification instantanée des conditions dans le générateur de vapeur, diminuant sa capacité à refroidir l’eau du circuit primaire baignant le coeur du réacteur. La hausse de température dans celui-ci entraîna une augmentation de la pression. La soupape de décharge du pressuriseur du circuit primaire s’ouvrit automatiquement trois secondes plus tard (t = 3 s), abaissant la pression. Ensuite, à t = 8 s, la turbine et le réacteur s’arrêtèrent à leur tour. Jusque là tout se passait conformément au scénario prévu dans ce genre d’incident. Malheureusement, le voyant de la soupape indiquait, à tort, une vanne fermée. Conséquence : la pression continuait à baisser et vapeur et eau radioactive se déversaient dans l’enceinte principale du cœur. Des phénomènes complexes de turbulence se produisirent dans le circuit primaire et dans la cuve, laissant supposer à l’opérateur que le pressuriseur était plein d’eau. Il en conclut que le circuit primaire l’était également et il arrêta manuellement le circuit d’injection de sécurité. Nous sommes à t = 4 min 38 s. A 5 min 30 s, l’eau se mit à bouillir à la sortie du cœur et le circuit primaire se vida directement dans l’enceinte de confinement qui constituait la troisième et dernière barrière de confinement de la radioactivité. Le coeur se mit à fondre et il y eu production d’hydrogène dans l’enceinte.
Durant les heures suivantes, les opérateurs tentèrent de remplir le circuit primaire en eau. Malheureusement cette opération s’avéra très difficile à cause de la présence d’une bulle d’hydrogène piégée dans les parties hautes des générateurs de vapeur. La situation finit par se stabiliser et les pompes du circuit primaire furent remises en route à t = 15 h 49’.
Quel fut le bilan de cet accident ?
Six ans après cette catastrophe, une inspection par caméra permit de découvrir que 50% du coeur avait fondu, formant un corium5 solidifié et que 20% avait coulé au fond de la cuve sans percée celle-ci. L’enceinte de confinement, troisième barrière, a joué son rôle à l’exception d’un léger rejet radioactif.
Toutefois, 200.000 personnes ont été évacuées par mesure de précaution à la suite d’une radioactivité significative près de la centrale. La contamination fut en fait très faible et aucune conséquence pathologique n’a été détectée sur la population avoisinante.
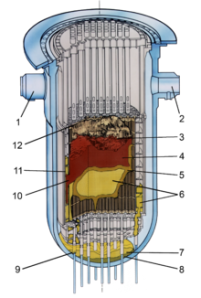
Fig. 4 – Cœur du réacteur après l’accident
VIII. L’ACCIDENT DE TCHERNOBYL
Le site de la centrale nucléaire Lénine se situe sur la rive de la rivière Pripiat, un affluent du Dniepr, à environ 15 Km de la ville de Tchernobyl et 110 Km de Kiev. Il comporte quatre réacteurs de type RBMK. Des défauts de conception et des violations des procédures de conduite sont à l’origine de la catastrophe qui est survenue à l’unité 4, le 26 avril 1986. C’est l’accident nucléaire civil le plus grave à ce jour. Il a fortement marqué les esprits de l’opinion mondiale et renforcer la détermination des écologistes dans leur lutte contre l’utilisation du « nucléaire ».
Une équipe d’ingénieurs en électrotechnique n’ayant aucune connaissance dans le domaine du nucléaire, venue de Moscou, veut tenter un exercice afin de démontrer la possibilité de relancer la centrale au moyen de l’énergie cinétique des alternateurs durant une coupure extérieure d’électricité. De plus, le directeur de la centrale était un ingénieur en thermodynamique et non un spécialiste du nucléaire. Deux erreurs dans le choix du personnel responsable et devant piloter ce genre de matériel !
Un test à faible puissance était prévu, régime de fonctionnement particulièrement instable dans ce type de filière.
En début d’opération, le 25 avril à 13 h 05, deux turbines et la moitié des pompes sont en fonctionnement. La puissance est réduite à 25%, ce qui provoqua un empoisonnement du réacteur dû à la production de xénon. Conséquence immédiate, la puissance tombe à 30 MW, alors qu’elle est normalement de 1.000 MW !
Malgré l’inquiétude et l’avertissement des opérateurs, Moscou ordonne la poursuite de l’essai. Pour faire remonter la puissance, les techniciens retirent les barres de contrôle, n’en laissant que 26 dans le réacteur. Deux pompes supplémentaires du circuit primaire sont enclenchées et les circuits de sécurité sont débranchés volontairement malgré les alarmes. Conséquence de cette série de manœuvres non appropriées : le point de non retour est atteint à 1 h 05, la puissance se stabilisé à 200 MW et toutes les pompes sont activées.
Il en résulte :
– un excès de débit d’eau dans le circuit primaire ;
– que le niveau d’eau liquide baisse dans les ballons ; que la pression chute dans ceux-ci ;
– que l’alarme de chute de pression se déclenche.
La radiolyse de la vapeur d’eau produit un mélange détonant d’oxygène et d’hydrogène. Cette situation provoque une première explosion thermique.
En 4 minutes la puissance est multipliée par 100, provoquant l’emballement de la réaction en chaîne. C’est la catastrophe ! Une deuxième déflagration du mélange détonant se produit, déchirant l’enveloppe du graphite et faisant éclater et projetant dans les airs la dalle de béton de plus de 1.000 tonnes avant qu’elle ne retombe sur le réacteur, le couvrant en partie et brisant les infrastructures. Le graphite mis à l’air prend feu et les températures élevées (3.600 à 3.800 °C) provoquent la fusion d’une partie du combustible ainsi que son évaporation avant d’être propulsé dans l’atmosphère par l’explosion puis dispersé par les vents en direction du nord-est, au-delà des frontières de l’Union soviétique.
Du cœur du réacteur à l’air libre s’échappent des rayonnements et des neutrons.
Dans cet accident majeur, on peut discerner trois causes :
1. des erreurs de conception : instabilité à faible régime, barres de contrôle, absence d’enceinte de confinement ;
2. des causes politiques : le cloisonnement de l’information, l’incompétence des responsables ;
3. des erreurs et fautes des exécutants : violation des consignes permanentes, non respect de la procédure d’essai, quatre mises hors circuit volontaires de dispositifs de sécurité.
Conséquences de la catastrophe de Tchernobyl
Des 150 tonnes de combustible de dioxyde d’uranium et de produits de fission que contenait l’unité 4, 13 à 30% se sont échappés dans le milieu environnant. La radioactivité libérée correspond à 12.1018 Bq, dont 6.1018 Bq dues au xénon 133, d’une durée de vie de 5 jours. Seulement 3 à 5% du combustible solide a été éjecté. Par contre 100% des gaz nobles et 20 à 60% des radioéléments volatils se sont retrouvés dans l’atmosphère. Le nuage radioactif contenait environ 1,7.1018 Bq d’iode 131, soit 6 fois plus que les bombes d’Hiroshima et de Nagasaki, et 8,5.1016 Bq de césium 137, soit 560 fois supérieure aux deux bombes. La pluie a déposé une grande partie des éléments dans l’environnement proche du site. L’iode a eu un effet initial plus prononcé sur la santé car il se fixe sur la thyroïde. Cependant sa durée de vie n’est que de 8 jours, tandis que celle du 137Ce est de 30 ans causant de dégâts à plus long terme.
La contamination fonction des conditions climatiques se répartit principalement sur la Biélorussie (70% des retombées), sur l’Ukraine, la Russie et le reste de l’hémisphère Nord. La distribution de celle-ci est très inhomogène à cause de la localisation des pluies. Près de 5 millions de personnes en Ukraine et en Biélorussie ont été exposées à des doses notables de radiations. Des doses plus faibles ont été dispersées sur de vastes régions où vivent des centaines de millions de personnes dans l’hémisphère Nord.
Ceux qui ont payés le plus lourd tribut furent les liquidateurs et les pompiers, ainsi que les nettoyeurs de la zone contaminée à moins de 30 Km de la centrale, soit près de 800.000 individus. Les estimations du nombre de victimes s’étalent d’une cinquantaine de morts jusqu’à plus de 100.000. Les plus fortes doses ont été reçues par le millier de personnes qui est intervenu dans les premiers jours pour arrêter les incendies et essayer de recouvrir le réacteur.
IX. L’ACCIDENT DE FUKUSHIMA
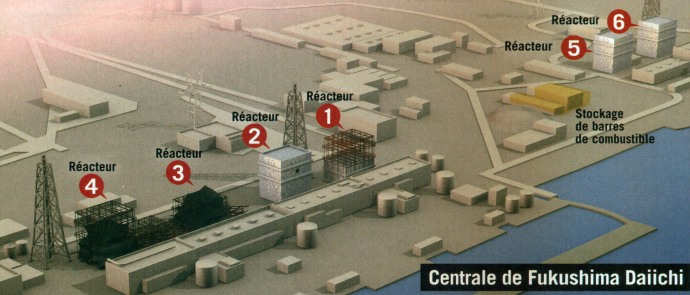
Le complexe nucléaire de Fukushima-Daiichi ou Fukushima I est l’un des 25 plus grands au monde. Il comporte six unités du type REB. Il se situe sur la côte orientale de l’île de Honshu, face à l’océan Pacifique, à environ 225 Km de Tokyo. Un deuxième complexe, Fukushima II ou Daini se trouve à 12 Km au sud du premier.
Fig. 5 – Centrale de Fukushima-Daiichi
Les causes de l’accident de Fukushima sont dues à un séisme de magnitude 9, qui débuta le 11 mars 2011 à 14 h 46 heure locale, suivi d’un tsunami dont les vagues atteignirent plus de 20 mètres d’amplitude face à certains endroits encaissés de la côte. 11 réacteurs sur les 56 que compte le Japon furent affectés à la suite du tremblement de terre. A Fukushima, le mur de protection contre les tsunami était conçu pour résister à des vagues hautes de 5,5 mètres, alors qu’elles atteignirent à cet endroit plus de 14 mètres du fait de leur énergie cinétique. Pourtant, en 2009, des géologues japonais avaient mis en garde les responsables du site contre le risque d’un tsunami majeur. Ils rappelaient qu’en 1896 et 1933, des vagues de 38 m et de 29 m s’étaient abattues sur la côte orientale du Japon. Il n’avait été tenu aucun compte de cet avertissement, les concepteurs préférant se baser sur un tsunami survenu au Chili en 1956.
Ce type de réacteur est conçu pour s’arrêter automatiquement en cas de forte secousse sismique et devrait résister à un tremblement de terre de magnitude 7 ,9 . Dans un article paru le 11 août 2007 dans le quotidien International Herald Tribune/Asahi Shimbun, le sismologue Ishibashi KATSUHIKO lance l’avertissement suivant : « A moins que des mesures radicales ne soient prises pour réduire la vulnérabilité des centrales aux tremblements de terre, le Japon pourrait vivre une vraie catastrophe nucléaire dans un futur proche. »
Cet éminent professeur à l’Université de Kobe faisait partie du comité d’experts chargé d’établir les normes sismiques des centrales nucléaires japonaises. Il avait donné sa démission en protestation contre la position de ce comité dont il trouvait les recommandations trop laxistes. Dès 2006, année où les normes de sécurité anti-sismiques japonaises ont été renforcées, il avait prévenu les autorités que les centrales japonaises souffraient d’une « vulnérabilité fondamentale » aux séismes. Aussi bien le gouvernement japonais que l’exploitant Tepco (Tokyo Electric Power Company) ont ignoré ses avertissements. Les faits lui ont donné raison. Le 16 juillet 2007, un séisme de magnitude 6,8 a provoqué de sérieux incidents à la centrale de Kashiwazaki-Kariwa, la plus importante unité de production d’électricité nucléaire au monde. Cette centrale se trouve sur l’île de Honshu, la principale île du Japon, comme presque toutes les centrales nucléaires japonaises. Déjà en août 2005, la centrale d’Onagawa, au nord de Fukushima avait été affectée par un tremblement de terre, et en mars 2007 c’était le site de Shika qui avait subi un séisme dont l’épicentre se trouvait à 16 Km de la centrale. L’année suivante une secousse de 6,8 de magnitude se produisait à l’est de Honshu, près d’Onagawa et de Fukushima. Malgré des dégâts peu importants, Tepco signala trois fuites de liquide radioactif à Fukushima-Daiini.
L’exploitant a avancé des chiffres sur les secousses subies par la centrale de Fukushima au moment du séisme de mars 2011 : l’accélération dépasse les capacités de résistances calculées lors de la construction. L’unité 2 a encaissé une accélération horizontale de 550 Gals6 , supérieure de 26% à la norme pour ce genre de réacteur. L’accélération relevée pour l’unité 5 est de 548 Gals (21% au-dessus de la norme) et pour l’unité 3, elle est de 507 Gals (15% au-dessus de la limite acceptable).
Donc, l’accident de Fukushima n’est pas une surprise, même s’il a pris de court les opérateurs de la centrale et les autorités gouvernementales. Il est la conséquence de l’incurie des responsables qui ont préféré négliger les recommandations de certains experts.
Dans le cas d’un arrêt d’une unité, la réaction en chaîne n’est plus alimentée et elle s’éteint d’elle-même. Toutefois, à cause de l’énergie thermique résiduelle, il est impératif de continuer à refroidir le cœur du réacteur. Immédiatement après l’arrêt, celui-ci dégage encore près de 7% de sa puissance thermique nominale, pour tomber à environ 2% après une ½ heure et 1%, huit heures après l’arrêt. La chaleur résiduelle est éliminée par l’eau de refroidissement des circuits auxiliaires, dont les pompes et les systèmes de contrôle doivent être alimentés en électricité.
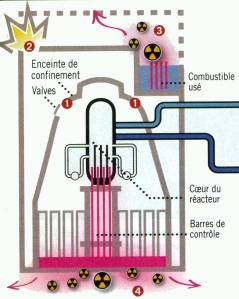
A la centrale de Fukushima-Daiichi les conséquences devinrent vite catastrophiques, après le passage du tsunami, 1 heure après le séisme. Les unités 1, 2 et 3 se sont arrêtées automatiquement lors du séisme, mais le tsunami provoqua une panne générale d’électricité, en submergeant la partie basse de la centrale, ce qui entraîna l’arrêt des circuits de refroidissement et des systèmes de secours censés prendre le relais (groupes électro-gènes). Les réacteurs n’étant plus refroidis, le volume d’eau diminue par évaporation, pouvant entraîné la fusion du coeur. Le point de fusion du combustible est d’environ 2.800°C. La gaine en zirconium se détériore à partir de 830°C. Par une réaction oxydante avec l’eau cette dernière se rompt vers 1.200°C, et produit de l’hydrogène. Elle fond à environ 1.600°C.
Fig. 6 – Scénarios de rejets
Dans l’enceinte de confinement, la vapeur d’eau produite provoque une augmentation de la pression. Afin de rabaisser celle-ci les opérateurs sont amenés à effectuer des décompressions volontaires, avec rejet d’éléments radioactifs, entraînant une contamination partielle de l’environnement immédiat. L’hydrogène au contact de l’oxygène de l’air peut exploser
Trois des six unités connurent ce sort : réacteurs n° 1, n° 2 et n° 3. Les trois autres étaient à l’arrêt pour maintenance. Le samedi 12 mars, une première explosion eut lieu dans l’unité 1 qui détruisit le toit et la structure supérieure du bâtiment, blessant au moins quatre personnes. La structure du réacteur 3 est détériorée de la même manière le 14 mars, tandis que celle du réacteur 2 explose le 15 mars. Des produits de fission comme l’iode 131 et le césium 137, ont été relâchés dans l’atmosphère.
Les piscines de désactivation de ces différentes unités, contenant le combustible usagé mais chaud, constituaient un autre sujet d’inquiétude. Elles doivent être également continuellement refroidies car les crayons de matière dégagent toujours de la chaleur. Malheureusement à Fukushima, ces piscines sont situées en dehors de la zone de confinement des réacteurs et sont de ce fait plus facilement exposées à l’atmosphère. Si l’approvisionnement en eau de refroidissement se tarit, le contenu de la piscine s’évapore et les crayons se retrouvent hors eau. Dans ce cas, elles se mettraient à brûler spontanément pour atteindre une température de 2.200°C et provoquer leur éclatement avec éjection de produits hautement radioactifs dans l’atmosphère.
Différents moyens furent mis en œuvre afin de refroidir les réacteurs et de remplir les piscines : injection d’eau de mer, enrichie au bore, largage depuis des hélicoptère et camions équipés de canons à eau. Dans un premier temps ces manœuvres s’avérèrent inopérantes étant donné le taux élevé de radiations qui empêchait une approche suffisante des sites contaminés. Par la suite, l’alimentation électrique pu être rétablis et les pompes d’alimentation remises en circulation. L’eau de mer, dont le sel se cristallisait autour des barres de combustible, fut remplacé par de l’eau douce plus efficace pour le refroidissement. L’eau issue du refroidissement des différentes unités est fortement radioactive et en un mois, environ 60.000 m³ ont été récupérées. La place manque pour les stocker avant de les retraiter ce qui pose un nouveau problème de contamination si cette eau est stockée à l’air libre.
En résumé
Les systèmes de refroidissement des unités 1, 2 et 3 sont tombés en panne. Les bâtiments qui les abritent ont subi des explosions d’hydrogène. Les trois réacteurs sont actuellement en fusion partielle et leurs cuves fortement endommagées.
Dans l’unité 1, à la suite du remplissage de la piscine de stockage, de l’eau stagnante radioactive couvrait le sol de la salle des turbines. Les doses relevées étaient de 2,1×105 Bq/cm³ d’iode 131 et 1,8×106 Bq/cm³ de césium 137. Au 1er juin, après le passage d’un typhon, les sous-sols étaient recouverts de plus de 5 mètres d’eau, à moins de 40 cm du niveau du sol.
Dans l’unité 2, l’eau stagnante dans le bâtiment est également fortement radioactive et s’écoule vers la mer par une fissure d’environ 20 cm dans le béton de confinement ou le puits de la fosse contenant les câbles d’alimentation.
Le réacteur 3 avait été adapté afin de pouvoir brûler du combustible MOX qui se compose de dioxyde d’uranium (UO2) et de dioxyde de plutonium (PuO2), composé très toxique. Les taux de plutonium relevé aux alentours de cette unité montre que la cuve de confinement du réacteur est rompue. Un écoulement radioactif vers la mer a également été détecté.
Le réacteur 4, en raison de travaux sur la cuve, était à l’arrêt et ne comportait pas de combustible. Par contre sa piscine comportait du combustible usagé et du combustible frais. Faute d’alimentation, la température de cette dernière s’est accrue considérablement (84°C). Le 15 mars, le hall d’opération de l’unité 4 est victime de deux grosses explosions qui causent deux brèches d’environ huit mètres de large sur l’enceinte extérieure. Elles seraient dues à deux incendies qui se sont déclenchées au niveau de la piscine.
Les réacteurs 5 et 6 étaient hors service pour entretien. Aucune fuite n’étant à déplorer dans les circuits de refroidissement, il ne fut pas nécessaire de procéder à une dépressurisation.
Dès le 12 mars, les autorités étendent la zone d’évacuation de 10 à 20 Km autour de la centrale, et le 16 mars elle passe à 30 Km. Ce même jour, les responsables ordonnent l’évacuation temporaire du personnel de la centrale (une équipe de 70 personnes) en raison de la hausse dangereuse du niveau de radioactivité sur le site, mesurée à 400 mSv par heure aux abords de la centrale.
Contamination :
Selon les estimations de l’Agence Japonaise de Sûreté Nucléaire, la catastrophe de Fukushima aurait dispersé dans l’atmosphère l’équivalent de 10% de celle de Tchernobyl, soit entre 1,3 et 1,5.1017 Bq d’135I, et entre 6,1 et 12.1015 Bq de 137Ce
Des prélèvements de sols ont été réalisés, à 40 Km à l’ouest de la centrale de Fukushima Daiichi, près des routes à 5 cm de profondeur. Les niveaux de radioactivités sont de 43.000 Bq/Kg pour l’131I et de 4.700 Bq/kg pour le 137Ce. Soit 400 fois plus que les niveaux d’émission habituels pour l’iode.
Des substances radioactives ont également été détectées dans l’eau de mer dans les environs de la centrale, ainsi que dans l’estuaire de la rivière Tomioka à 8 Km au sud. Les taux relevés pour l’131I représentent 80 fois la norme autorisée au Japon.
Des mesures du ministère japonais de la santé, effectuées dans cinq villes de la préfecture de Fukushima, ont montré que l’eau du robinet contient des niveaux d’131I de 120 à 220 Bq/Kg. D’après les limites fixées par le Codex alimentaire de l’OMS, le niveau d’131I ne doit pas dépasser 100 Bq/Kg dans la nourriture destinées aux enfants.
Des analyses d’échantillons de sols prélevés en cinq points les 21 et 22 mars sur le site de la centrale ont révélé la présence de plutonium 238, 239 et 240. Les concentrations sont comparables à celles que les essais nucléaires atmosphériques de l’après-guerre ont laissées par déposition dans les sols. La composition isotopique d’au moins deux des échantillons suggère que le plutonium provient des combustibles utilisés dans la centrale.
Conclusions :
L’exploitant TEPCO et le gouvernement japonais n’ont pas tenu compte des mises en garde des différents experts et ont sous-estimé les risques sismiques et de tsunami.
Durant les années précédentes la catastrophe, pour des raisons vraisemblablement de coût, TEPCO avoue avoir falsifié des rapports d’inspection constatant des fissures et de traces de corrosion sur les cuves de certains réacteurs
Une série d’erreurs humaines ont vraisemblablement aggravé la catastrophe.
Sur le réacteur n°1, la décompression n’a été effectuée qu’1 h 30 avant l’explosion, alors que la limite maximale de pression (853 kilopascals) était presque atteinte 13 heures avant cette dernière : si les procédures de secours avaient été correctement appliquées, l’explosion aurait pu être moins forte.
La gravité de cette suite d’incidents majeurs ne pourra être établie qu’à long terme comme pour la catastrophe de Tchernobyl. Elle a déjà été réévaluée plusieurs fois, notamment par la commission d’experts de l’AIEA (Agence International pour l’Energie Atomique).
X. BIBLIOGRAPHIE
• BASDEVANT J.-L. (2011) – Maîtriser le nucléaire – Que sait-on et que peut-on faire après Fukushima ?, Eyrolles
• CHARPAK G., GARWIN R.L., JOURNE V. (2005) – De Tchernobyl en Tchernobyls, Odile Jacobs.
• MOLITOR M. (2011) – Tchernobyl – Déni passé, menace future ?, Racine RETBF
• TCHERTKOFF W. (2006) – Le crime de Tchernobyl – Le goulag nucléaire, Actes Sud
• « Que s’est-il passé à Three Mile Island et à Tchernobyl ? », article paru dans le journal Le Monde du mardi 18 mars 2011.
• « La catastrophe au Japon – Le nucléaire en questions », in Sciences et Avenir – n° 770, avril 2011.
• http://fr.wikipedia.org/wiki/Centrale_nucl%C3%A9aire
• http://fr.wikipedia.org/wiki/Liste_des_accidents_nucl%C3%A9aires
• http://www.laradioactivite.com/fr/site/pages/reacteursrbmk.htm
• http://www.laradioactivite.com/fr/site/pages/Reacteurs_REB.htm
• http://fr.wikipedia.org/wiki/Accident_nucl%C3%A9aire_de_Fukushima
• http://www.sciencesetavenir.fr/actualite/crise-nucleaire-au-japon/20110312.OBS9531/crise-nucleaire-au-japon-le-fil-des-evenements.html
Notes
2 – Le terme technique « watt électrique » (symbole : We) correspond à la production de puissance électrique. Ses multiples sont le mégawatt électrique (MWe) et le gigawatt électrique (GWe), par opposition au terme technique « watt thermique » (symbole : Wt ou Wth) qui lui correspond à la production de puissance thermique. Ses multiples sont le mégawatt thermique (MWt ou MWth) et le gigawatt thermique (GWt ou GWth).
Cette précision est utilisée couramment pour distinguer la production électrique de la dissipation thermique d’une centrale. La puissance d’une centrale est généralement exprimée sous forme de puissance électrique (correspondant au terme technique « MWe »). La puissance thermique d’une centrale nucléaire est typiquement trois fois sa puissance électrique. La différence correspondant au rendement thermodynamique (directement lié à la température de fonctionnement) et aux pertes de conversion, étant donné que la transformation d’énergie thermique en énergie électrique ne peut se faire qu’avec des pertes (rendement de l’ordre de 30 à 40 %). Elle explique le besoin de refroidissement important des centrales thermiques. Par exemple, la centrale nucléaire d’Embalse en Argentine génère 2.109 MW de chaleur (2.109 MWth) pour seulement 648 MW d’électricité (648 MWe).
3 – Dans le cas des installations nucléaires, il s’agit d’un ensemble de dispositions (automatismes, systèmes ou procédures) redondantes et diversifiées permettant de limiter l’effet d’incidents ou d’accidents.
4 – Le becquerel (symbole : Bq) est l’unité dérivée du Système International (SI) pour l’activité d’un radionucléide et correspond à une désintégration par seconde. L’activité d’une substance est définie comme le nombre de désintégrations radioactives par seconde au sein d’une certaine quantité de matière.
5 – Corium : amas de combustible et d’élément de structure du cœur d’un réacteur nucléaire fondus et mélangés à la suite d’un accident grave.
6 – Gal : unité de mesure employé en géodésie et en géophysique pour exprimé l’accélération de la pesanteur et valant 10-2m/s².