- L’état solide;
- L’état liquide;
- L’état gazeux
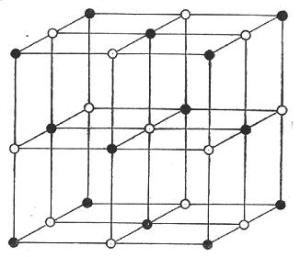
Le véritable état solide est l’état cristallin (fig. 28). Dans ce cas, les atomes sont ordonnés selon une disposition géométrique bien définie. Nous avons affaire à un réseau cristallin dans lequel les proportions restent caractéristiques des espèces chimiques. Toutefois, l’individualité de la molécule n’est pas exactement définie; chaque atome est lié à ses voisins sans que rien ne permette de le rattacher plus particulièrement à l’un ou à l’autre.
Fig. 28 – Exemple d’un réseau cristallin composé de deux types d’atomes (boules noires et blanches)
Par contre dans l’état amorphe, la disposition des molécules est confuse et incohérente.
L’état liquide et l’état amorphe sont analogues du point de vue disposition des molécules. La différence réside dans le fait que dans l’état amorphe, les molécules sont relativement fixes l’une par rapport à l’autre; dans l’état liquide, elles se déplacent continuellement l’une par rapport à l’autre.
Dans le cas d’un gaz, les particules, animées de très grandes vitesses et éloignées les unes des autres, échappent presque complètement à leurs actions mutuelles, ce qui permet d’expliquer l’expansibilité et la diffusion rapide des gaz.
C. La théorie cinétique des gaz
La théorie cinétique des gaz est à la base de l’atomistique. Elle se propose comme premier but d’interpréter la loi des gaz parfaits :
pV = RT (loi de Mariotte et de Gay-Lussac)
Dans laquelle p représente la pression du gaz : V désigne le volume moléculaire du gaz ; T la température absolue et R la constante du gaz rapportée à une molécule-gramme.
A l’état gazeux, les molécules comprennent un nombre limité d’atomes. Selon la loi d’Avogadro-Ampère, un volume déterminé de gaz contient un nombre fixe de molécules – dans des conditions données de température et de pression -, quel que soit le nombre d’atomes associés dans chaque molécule. Le nombre de molécules compris dans 22.412 cm³ de gaz, à 0° C et sous une pression de 760 mm de mercure, conditions normales de température et de pression (en abrégé : T.P.N.), s’élève à :
N = 6,025 44 x 1023 (nombre d’Avogardro)
On désigne par mole la quantité de substance d’une même espèce chimique qui contient N molécules. S’il s’agit d’oxygène, le poids d’une mole est, par définition du nombre d’Avogardro, 32,000 g. La masse moléculaire est la masse d’une mole d’un composé chimique. La masse de N atomes d’une même espèce est appelée masse atomique.
La théorie cinétique des gaz décrit ces derniers comme simplement constitués de ces innombrables molécules qui s’agitent en tous sens, se déplaçant en ligne droite, jusqu’à ce qu’un choc contre une autre molécule les dévie. A chaque choc, il y a échange d’énergie et de quantité de mouvement entre les deux molécules.
Les chocs répétés contre les parois constituent ce que, d’un point de vue macroscopique, nous appelons la pression.
Pour un gaz thermiquement isolé de l’extérieur et placé dans une enceinte indéformable, il y a conservation de l’énergie totale et, par suite, de l’énergie moyenne des molécules. Cette énergie moyenne est proportionnelle à la température absolue. A dire vrai, il faut parler ici de l’énergie moyenne par degré de liberté. Si la molécule peut être considérée comme sphérique (molécule mono-atomique), elle a 3 degrés de liberté susceptibles d’entraîner des échanges d’énergie au cours des chocs. Les molécules diatomiques ont la forme d’haltères; elles possèdent 5 degrés de liberté susceptibles de donner lieu à échanges d’énergie; pour les molécules plus grosses, les 6 degrés d’un corps solide doivent intervenir.
On démontre qu’à la température absolue T, l’énergie cinétique moyenne de translation des molécules est indépendante de la nature du gaz et vaut :
1/2 mū² = 3/2 RT/N
Cette formule est à rapprocher de la loi des gaz parfaits donnée ci-avant. La quantité k = R/N est une constante universelle, appelée constante de Boltzmann, et vaut 1,38 x 10-16 erg/°C.
En fait, les vitesses de molécules de gaz ne sont pas égales : par suite des chocs, certaines augmentent, d’autres diminuent, mais il s’établit un équilibre statistique dans lequel le nombre relatif dn/n des molécules de vitesse comprise entre u et u + du est égal à :
formule dans laquelle T désigne la température absolue et m la masse de la molécule de gaz.
Pratiquement, ū vaut 1.838 m/s pour l’hydrogène, dans les conditions normales de température et de pression, et 485 m/s pour l’air.
Le libre parcours moyen d’une molécule entre deux chocs successifs peut être calculé. Dans l’air, sous les mêmes conditions normales, il est de l’ordre de 10-5 cm.
D. Constitution de l’atome
- un noyau central porteur de la presque totalité de la masse (99,9%) et d’une charge électrique positive égale à un multiple entier Z de l’unité atomique d’électricité e = 1,6 x 10-19 Coulomb ;
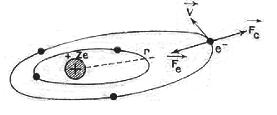
- une couronne électronique comportant Z électrons de masse très faible (9,1 x 10-28 g), porteurs chacun d’une charge électrique négative égale à e. On a d’abord imaginé ces électrons comme des planètes « gravitant » autour du « soleil » constitué par le noyau (modèle de Rutherford et de Bohr) ; une telle image a été condamnée par l’introduction de la mécanique ondulatoire qui ne permet plus d’envisager leurs trajectoires comme des orbites à l’image de celles de la mécanique céleste. Nous aurons seulement le droit de parler des valeurs, en chaque point de l’espace, de la probabilité de présence de l’électron : on utilise parfois l’image d’un nuage de probabilité, d’autant plus dense que la probabilité est plus forte.
Les dimensions de l’atome sont du même ordre de grandeur que celles de la molécule (10-10 m). Le noyau est dix mille fois moins large que l’atome (10-15 m).
3. La couronne électronique
La couronne électronique comprend les électrons dont les dimensions ne sont pas précises. La charge électrique négative d’un électron est de -1,60.10-19 Coulomb et sa masse m = 9,104.10-31 kg.
Il tourne sur lui-même et possède donc un moment cinétique (produit du moment d’inertie par la vitesse angulaire) égal à 1/2 h/2π, h étant la constante de Planck et valant 6,62.10-34 joule-seconde. Ce moment d’inertie porte le nom de spin. La rotation sur elle-même d’une masse électrisée équivaut à une distribution de courants identique à celle qui règne dans un solénoïde; l’électron possède donc des propriétés magnétiques que l’on caractérise par un moment magnétique, produit du courant par l’aire qu’il embrasse et que l’expérience montre égale à -(1/2).(h/2π).(ε/m), ε étant la charge, en module, de l’électron et m sa masse. Le signe – indique que le moment magnétique est opposé au moment cinétique ou spin. Connaissant les valeurs de h, ε et m, il est facile de calculer la valeur du moment magnétique qui est de -9,17.10-24 ampère-mètre carré.
Masse, charge électrique, spin et moment magnétique sont les seules données concrètes précises sur l’électron.
4. Le noyau
Un noyau se caractérise par sa charge (c’est-à-dire) par le nombre Z), sa masse M, son spin s et son moment magnétique M, grandeurs déjà définies pour l’électron.
En ce qui concerne sa constitution, le noyau résulte de l’assemblage de particules lourdes appelées nucléons. Ces derniers se manifestent sous deux états (états quantiques internes) :
- proton : on considère que dans le proton, les charges électriques positives s’accumulent à sa périphérie tandis que les charges négatives sont concentrées au centre. Ces dernières sont en nombre insuffisant pour compenser les premières ce qui explique la charge positive du proton. Il possède une masse de 1,665 10-27 kg, une charge positive +ε égale à 1,60 10-19 coulombs, un spin 1/2.h/2π et un moment magnétique de +1,40 10-26 ampère-mètre carré ;
Fig. 29 – A droite, le proton; à gauche, le neutron
- neutron : dans cette particule, les charges électriques se répartissent de la manière inverse de celle du proton. Mais les charges négatives sont en nombre suffisant pour compenser les charges positives, ce qui explique la charge nulle du neutron. Il possède une masse légèrement plus forte de 1,666 10-27 kg, une charge nulle, un spin identique à celui du proton et un moment magnétique de -0,97.10-26 ampère-mètre carré.
5. Conclusions provisoires
La mécanique ondulatoire permet d’affirmer qu’à chaque particule correspond une antiparticule. C’est ainsi que l’on détecta la présence du positron (électron +), celle de l’antiproton (inverse du proton) et de l’antineutron (inverse du neutron). Ces antiparticules possèdent une durée de vie très courte car lorsqu’elles rencontrent le corpuscule correspondant, il y a annihilation de la matière en énergie.
Fig. 30 – A droite, l’antineutron; à gauche, l’antiproton
Ce qui précède est la manière la plus simple de concevoir un atome, basée sur le modèle de Bohr et que l’on nous enseignait dans les années 1950-1960. Les atomistes ont une vision beaucoup plus complexe car ils font intervenir en plus de la mécanique ondulatoire, la mécanique quantique et la relativité. Arrêtons-nous là pour l’instant dans l’approche théorique et posons-nous la question de savoir quelles sont les étapes qui ont permis d’arriver à ce modèle d’atome.
E. HISTOIRE DE L’ATOME
Démocrite (460 – 370 av. J.C.) précise et développe la théorie atomiste de Leucippe (460-370 av. J.C.), mal connue, en élaborant un Univers matérialiste, composé d’une infinité d’atomes qui se combinent au hasard de leurs rencontrent pour former des ensembles de plus en plus complexes. Cette conception atomiste a une forte résonance moderne et c’est la seule. Elle sous-tend l’idée d’évolution et de continuité de la matière à la vie. L’Homme et les animaux sont nés de la terre. C’est la première physique purement matérialiste qui exclut toute intervention finaliste, mythologique ou théologique, dans son explication du monde.
2. Le pudding de Thomson
C’est le physicien français Ampère (1775 –1836) qui, le premier, en 1814, sut distinguer la molécule de l’atome. Il édifia la théorie de l’électromagnétisme et jeta les bases de la théorie électronique de la matière.
Nous avons vu dans le chapitre sur « La découverte de la radioactivé »que J.J. Thomson avait, à la suite de ses expériences sur les rayons cathodiques, démontré que ceux-ci étaient en fait un flux de particules chargées. Par l’action combinée d’un champ électrique et d’un champ magnétique sur le faisceau de ces corpuscules, il démontra que le rapport de leur masse à leur charge (e/m) était indépendant de la nature du métal émetteur. Il en conclut qu’il avait affaire à un seul type de « corpuscule » qu’il appela dans un premier temps « atomes primordiaux » puis « électrons ».
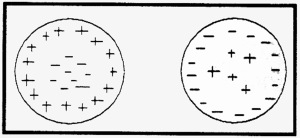
En 1904, il émit l’hypothèse d’un premier modèle d’atome. Il le concevait comme une sphère homogène et indivisible d’électricité positive dans laquelle les électrons s’enfonçaient – un peu comme un pudding dans lequel sont disséminés des raisins – jusqu’à ce que pour chacun d’eux il y ait équilibre entre l’attraction coulombienne due à la charge positive et la répulsion due aux autres électrons (fig. 31).
Fig. 31 – L’atome selon J.J. Thomson. Les électrons négatifs sont inclus dans une sphère d’électricité positive
En 1904, il émit l’hypothèse d’un premier modèle d’atome. Il le concevait comme une sphère homogène et indivisible d’électricité positive dans laquelle les électrons s’enfonçaient – un peu comme un pudding dans lequel sont disséminés des raisins – jusqu’à ce que
Avec son modèle, il entreprit d’expliquer les propriétés alors connues de la matière :
– émission de lumière visible par les corps portés à haute température ;
– émission de rayons X de même nature que la lumière visible mais de longueur d’onde beaucoup plus petite, lorsque les rayons cathodiques frappent un obstacle matériel ;
– émission par les atomes lourds de trois types de rayonnements : α, β et γ. C’était la radioactivité découverte par les Curie.
1° Les rayons α furent identifiés à des atomes d’hélium deux fois ionisés.
2° Les rayons β, animés de vitesses plus grandes que celles des rayons cathodiques, sont comme ceux-ci formés d’électrons négatifs.
3° Les rayons γ, semblables aux rayonnements X, mais beaucoup plus pénétrants.
J.J. Thomson essaya de rendre compte de l’émission de lumière et de rayons X par les atomes en imaginant des vibrations plus ou moins rapides des électrons au sein de la sphère pour répondre à la théorie de Maxwell selon laquelle un électron en mouvement de vibration émet de la lumière.
Toutefois, cette configuration posait de nombreux problèmes et entraînait beaucoup trop d’hypothèses. Il permit cependant de montrer que l’atome perdait sa caractéristique de particule insécable.
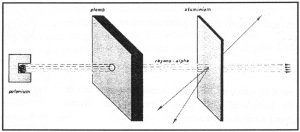
En 1911, Rutherford, maintenant à Manchester et lauréat du prix Nobel, à la suite de ses constatations sur la déviation des particules α traversant une plaque métallique, reprit le modèle de Perrin et le précisa. En fait, Rutherford cherchait à vérifier l’hypothèse de Thomson. Pour cela, il se lança dans une série d’expériences déjà entreprises par Hans Geiger (1882-1945) et Ernest Marsden (1889-1970) en 1909. Ceux-ci en étudiant le passage des rayons α dans la matière avaient constaté qu’une particule sur 20.000 environ subissait une déviation pouvant atteindre et dépasser 90°.
Rutherford utilisa le faisceau de rayons α émis par une source de polonium. Ce flux atteignait une plaque mince d’aluminium, après être passé au travers d’une ouverture dans un bloc de plomb afin d’éviter une trop grande dispersion. Il constata que la majorité des rayons traversaient la feuille d’aluminium, mais qu’un certain nombre était dévié, essentiellement vers l’arrière (fig. 33).
Le fait qu’un projectile α peut traverser en ligne droite une structure de plus de 100.000 atomes et subir exceptionnellement une déviation semblait incompréhensible dans le modèle de J.J. Thomson. Il en conclut que la charge positive, loin d’être répartie dans tout le volume de l’atome, devait se concentrer dans un très petit volume au centre de celui-ci qu’il appela « noyau » et que les vides entre les noyaux étaient très grands par rapport aux dimensions de ceux-ci.
Rutherford proposa son modèle après avoir établi une formule générale qui prévoyait pour un flux de particules électrisées traversant une épaisseur de matière, la proportion de celles que les noyaux atomiques dévieraient d’un angle donné; il soumit son calcul à l’expérience et obtint une vérification si parfaite que l’exactitude de son hypothèse semblait prouvée.
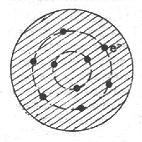
Dans ce modèle, les électrons ne sont plus incorporés dans l’atome selon celui de Thomson, mais gravitent autour du noyau à des distances relativement grandes et la force qui les attire est la force électrostatique de Coulomb. La somme de leurs charges électriques négatives compensent exactement la charge positive du noyau.
Dans la présentation des modèles de J.J. Thomson, de J. Perrin et de Rutherford, la préoccupation première des physiciens était d’expliquer les caractéristiques connues des atomes et notamment l’émission de lumière et de rayons X.
D’après la théorie de Maxwell-Lorentz, toute charge électrique dont le mouvement n’est pas rectiligne et uniforme doit émettre constamment de la lumière; ce devait être le cas pour les électrons planétaires de Rutherford soumis à l’accélération due au champ électrique, qui en perdant progressivement leur énergie devaient se rapprocher inexorablement du noyau en émettant un rayonnement continu. Cette conclusion était en contradiction avec les lois de l’électromagnétisme, avec les propriétés de stabilité de l’atome et elle ne correspondait pas aux observations montrant un rayonnement discontinu des atomes selon un spectre de raies caractéristiques.
Comment expliquer cette double énigme, si ce n’est en remettant en question la physique classique. Un jeune physicien, Niel Bohr osa, en 1912, prendre ce risque. Son idée de départ était simple. Il garda le modèle de Rutherford, et y raccrocha l’émission spectrale de la lumière en introduisant la notion de quantum.
[1] Eléatisme (Eléates) et héraclitéisme (Héraclite d’Ephèse) : deux lignées de philosophes grecs qui s’opposent aux autres écoles (physiologues, pythagoriciens et écoles pluralistes) en introduisant l’ontologie et la logique poussée jusqu’à l’absurde. Ils s’engagent résolument dans la voie purement philosophique et l’intellectualisme pur.
[2] Jean Perrin (Lille 1870 – New York 1942) : Il montra que les rayons cathodiques sont constitués de corpuscules négatifs (1895) et détermina le nombre d’Avogadro de plusieurs façons, apportant ainsi une preuve décisive de l’existence des atomes.
[3] J. Perrin – Les Atomes, p. 270.